03/03/2024 • 25 min de leitura
Atualizado em 30/07/2025Características do câncer: transformação celular, crescimento descontrolado e metástase
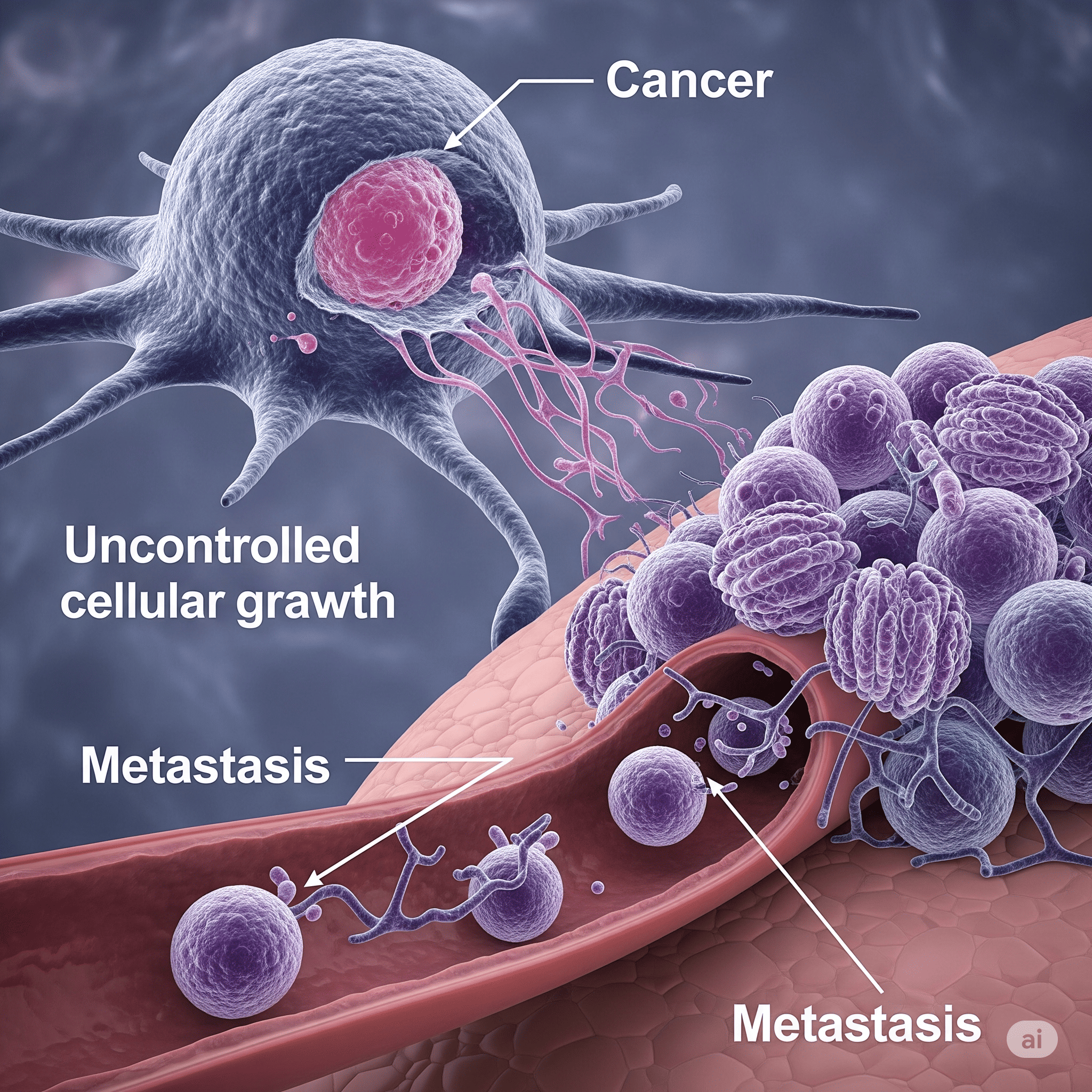
Entendendo o Câncer: Uma Jornada Didática pelas Características e Mecanismos da Doença
1. O que é Câncer? Desmistificando a Doença
Muitas vezes, o termo "câncer" evoca um senso de medo e incerteza. No entanto, é crucial entender que o câncer (ou cancro) não é uma única doença, mas sim um grupo heterogêneo de mais de cem doenças que afetam os seres humanos. Todas elas, porém, compartilham uma característica central e perturbadora: o crescimento celular anormal e descontrolado, com a capacidade de invadir tecidos adjacentes e se espalhar para outras partes do corpo, um processo conhecido como metástase.
Para contextualizar, imagine uma célula sadia do seu corpo. Ela possui um "manual de instruções" genético (DNA) que dita como deve crescer, dividir-se, funcionar e, eventualmente, morrer. No corpo, as células normalmente mantêm um equilíbrio delicado entre proliferação (divisão) e morte, garantindo a homeostase e a funcionalidade dos tecidos e órgãos. No câncer, há um erro nessas instruções genéticas, levando ao surgimento de uma célula alterada que ignora os controles normais de divisão e diferenciação.
É importante notar que nem todos os tumores são cancerosos. Existem os tumores benignos, que são aglomerados de células que crescem de forma desordenada, mas não invadem outros tecidos nem se espalham pelo corpo. Em contraste, o câncer é sinônimo de neoplasia maligna, que possui as propriedades invasivas e metastáticas.
2. As "Marcas" do Câncer: O Código de Identificação das Células Tumorais
Para organizar e racionalizar a complexidade dos diferentes tipos de câncer, os pesquisadores Douglas Hanahan e Robert Allan Weinberg propuseram, em artigos clássicos de 2000 e 2011, um conjunto de "Marcas do Câncer" (Hallmarks of Cancer). Essas marcas representam as capacidades funcionais que uma célula precisa adquirir para transitar da normalidade para um estado neoplásico maligno e formar tumores.
Inicialmente, foram descritas seis marcas, e posteriormente, mais duas foram adicionadas, além de "características habilitantes" ou promotoras:
Sinalização de Proliferação Sustentada: Células cancerosas mantêm uma sinalização contínua para sua própria proliferação, dividindo-se de maneira desordenada e descontrolada, mais rapidamente do que as células normais ao redor.
Evasão dos Supressores de Crescimento: Células normais possuem mecanismos de "freio" que impedem a proliferação excessiva. Células tumorais, no entanto, conseguem escapar da ação desses supressores de crescimento.
Resistência à Morte Celular: Diferente das células normais que ativam mecanismos de morte programada (apoptose) quando algo está errado, as células cancerosas adquirem resistência a esses sinais, prolongando sua sobrevivência.
Capacidade de Imortalidade Replicativa: As células tumorais conseguem se dividir um número ilimitado de vezes, muito além do limite normal para células do corpo. Isso é fundamental para sua persistência e crescimento.
Indução da Angiogênese: Para crescer e se manter ativas, as massas tumorais precisam de um suprimento constante de nutrientes e oxigênio. Para isso, as células tumorais estimulam a formação de novos vasos sanguíneos ao seu redor, um processo chamado angiogênese.
Ativação da Invasão e Metástase: As células cancerosas adquirem a capacidade de se desprender do tumor primário, invadir tecidos vizinhos e se deslocar para órgãos distantes, formando novos tumores.
Características Emergentes (Adicionadas em 2011): 7. Reprogramação do Metabolismo Energético: Células cancerosas adaptam seu metabolismo para suprir as demandas energéticas e de matéria-prima de seu crescimento acelerado, diferenciando-se do metabolismo de células normais. 8. Evasão do Sistema Imune: As células tumorais desenvolvem estratégias para evitar serem reconhecidas e destruídas pelo sistema imunológico do próprio corpo.
Características Habilitantes/Promotoras: Essas características fornecem as condições para que as células cancerígenas adquiram os traços funcionais mencionados acima.
Instabilidade Genômica: As células cancerosas acumulam mutações e anomalias em seu DNA, o que contribui para sua evolução e diversidade.
Inflamação Promovida por Tumor: A inflamação crônica no microambiente tumoral pode promover a proliferação, sobrevivência e migração das células cancerosas.
3. A Transformação Celular: O Processo da Carcinogênese
O desenvolvimento do câncer, também conhecido como carcinogênese ou oncogênese, é um processo complexo e, geralmente, lento, que envolve o acúmulo de alterações genéticas ao longo do tempo. Essa "dança" molecular leva à transformação progressiva de uma célula normal em uma célula cancerosa. Didaticamente, a carcinogênese é dividida em três estágios principais: Iniciação, Promoção e Progressão.
3.1. Estágio de Iniciação
A iniciação é a primeira etapa e resulta da exposição das células a um agente carcinogênico (oncoiniciador). Esses agentes, que podem ser químicos, físicos ou biológicos, causam alterações na estrutura genética (DNA) das células, as chamadas mutações.
Carcinógenos Químicos: Incluem substâncias como alquilantes, hidrocarbonetos policíclicos (presentes no fumo, por exemplo), aminas aromáticas e corantes azóicos. O tabagismo é o principal carcinógeno e causa cerca de 90% dos casos de câncer de pulmão, além de estar implicado em muitos outros tipos de câncer.
Carcinógenos Físicos: Radiações ionizantes (como raios X) e ultravioleta (luz solar) são exemplos. A radiação UV é a principal causa de câncer de pele não melanoma.
Carcinógenos Biológicos: Certos vírus (como o Papilomavírus Humano - HPV, relacionado ao câncer cervical; Vírus da Hepatite B e C, relacionados ao câncer hepático; Epstein-Barr e HTLV-1) e bactérias (como Helicobacter pylori, relacionada ao câncer gástrico) podem aumentar o risco de câncer.
Uma vez que a célula sofre uma mutação, ela se torna uma célula pré-iniciada. Nesta fase, o organismo ainda possui mecanismos de defesa. Erros no DNA podem ser reparados, ou a célula pode ser eliminada por apoptose (morte celular programada). Se esses mecanismos falham, a célula geneticamente alterada pode prosseguir para as próximas etapas, mas é importante ressaltar que a alteração ainda não é detectável clinicamente, e não há garantia de que o processo cancerígeno irá progredir.
3.2. Estágio de Promoção
Na promoção, as células iniciadas sofrem a ação de agentes oncopromotores. Esses agentes não causam mutações diretas no DNA, mas alteram a expressão de genes e estimulam a divisão das células já mutadas, através de um contato longo e continuado. Por exemplo, maus hábitos alimentares (alta ingestão de gordura saturada, baixa ingestão de fibras), obesidade e consumo excessivo de álcool são fatores promotores importantes. Neste estágio, a suspensão da exposição ao oncopromotor pode levar à parada do processo de carcinogênese.
3.3. Estágio de Progressão
A progressão tumoral é a fase em que ocorre a multiplicação descontrolada e irreversível das células. Há um acúmulo intensificado de mutações sucessivas e as células mutadas, agora consideradas pré-cancerígenas, adquirem vantagens adaptativas em relação às células normais. É neste estágio que o câncer se instala e evolui até as primeiras manifestações clínicas, podendo levar à formação de tumores malignos.
3.4. Genes Chave na Carcinogênese: O Duelo Molecular
A base do câncer reside em defeitos genéticos que afetam genes reguladores do crescimento e diferenciação celular. Esses genes podem ser divididos em duas categorias principais:
Proto-oncogenes e Oncogenes: Os proto-oncogenes são genes normais que, em seu estado natural, promovem a reprodução e o crescimento celular de forma controlada. Eles codificam proteínas que atuam como "aceleradores" do ciclo celular, como fatores de crescimento, receptores de fatores de crescimento ou proteínas de sinalização. Quando os proto-oncogenes sofrem mutações ativadoras, eles se transformam em oncogenes. A ação dos oncogenes é dominante, o que significa que uma mutação em apenas um dos alelos (cópias) do gene já é suficiente para conferir à célula uma vantagem de crescimento, levando à neoplasia. Essa ativação pode ocorrer por diversos mecanismos:
Translocação Cromossômica: Parte de um cromossomo se quebra e se liga a outro cromossomo, criando um novo gene fundido. Um exemplo clássico é o gene bcr-abl na leucemia mieloide crônica (LMC).
Amplificação Gênica: Aumento no número de cópias de um gene, levando à superprodução da proteína correspondente.
Mutação Pontual: Uma única alteração na sequência de DNA que muda um aminoácido ou cria um sinal de parada precoce. A mutação KRAS é um exemplo muito estudado, sendo o oncogene mais comumente mutado em cânceres humanos, resultando em uma proteína KRAS constantemente ativa que promove proliferação e sobrevivência celular.
Inserção Retroviral: Vírus inserem seu material genético perto de proto-oncogenes, ativando-os.
Genes Supressores de Tumor: Esses são os genes "freio" do ciclo celular. Eles atuam inibindo a divisão celular, promovendo o reparo do DNA e induzindo a morte celular (apoptose) quando necessário. A função desses genes é recessiva, o que significa que ambos os alelos do gene precisam estar perdidos, mutados ou não-funcionais para que a inibição do crescimento seja abolida e a célula adquira uma vantagem proliferativa. Isso é conhecido como a "teoria dos dois golpes" de Knudson. Os exemplos mais estudados e importantes para concursos são:
Gene p53: Considerado o "guardião do genoma". O p53 é o gene supressor de tumor mais frequentemente mutado, presente em mais de 50% dos cânceres humanos. Ele é ativado em resposta a estresses celulares, como danos no DNA, hipóxia ou ativação de oncogenes. Quando ativado, o p53 pode induzir a parada do ciclo celular para reparo do DNA ou direcionar a célula para a apoptose. Sua disfunção permite que células anormais se proliferem.
Gene Retinoblastoma (Rb): Outro supressor tumoral crucial, especialmente na transição da fase G1 para S do ciclo celular. Quando o Rb não está fosforilado, ele impede o avanço do ciclo celular, reprimindo fatores de transcrição importantes para a proliferação. Mutações no Rb levam à perda desse controle.
Outros supressores de tumor incluem BRCA1 e BRCA2 (relacionados ao câncer de mama e ovário) e p16 (relacionado ao melanoma maligno e câncer de pâncreas).
3.5. Heterogeneidade Tumoral: Um Desafio Terapêutico
Um aspecto crucial do câncer é sua heterogeneidade. Mesmo dentro de um único tumor, coexistem diferentes subpopulações de células cancerígenas (subclones) que podem apresentar variações genotípicas e fenotípicas significativas, como taxa de divisão, nível de malignidade e resposta a tratamentos. Essa diversidade é um motor da evolução do câncer e um grande obstáculo para o tratamento eficaz, pois algumas células podem se tornar resistentes a medicamentos.
A heterogeneidade pode ser observada em diversos níveis:
Intratumoral ou Intercelular: Diferenças entre células dentro do mesmo tumor.
Intertumoral Intra-paciente: Diferenças entre múltiplos tumores do mesmo tipo em um paciente.
Inter-paciente: Diferenças entre tumores em diferentes pacientes, explicando por que a mesma doença pode ser distinta em indivíduos distintos.
3.6. Alterações Epigenéticas: Além das Mutações no DNA
Além das mutações genéticas, o câncer também é impulsionado por alterações epigenéticas. Diferente das mutações que alteram a sequência de nucleotídeos do DNA, as alterações epigenéticas são modificações que afetam a expressão dos genes sem mudar a sequência subjacente do DNA. Elas podem ser hereditárias e persistem através das divisões celulares, sendo consideradas "epimutações". Exemplos importantes incluem:
Metilação do DNA: A adição de grupos metil a regiões promotoras de genes pode silenciá-los. Em câncer, isso pode levar à inativação de genes supressores de tumor.
Modificações de Histonas: Alterações nas proteínas histonas, que empacotam o DNA, podem afetar a acessibilidade do DNA para transcrição.
Imprinting Genômico: Modificações reversíveis do DNA que causam expressão diferente de genes herdados do pai ou da mãe. A perda do imprinting fisiológico pode ativar oncogenes ou silenciar genes supressores de tumor.
Essas alterações contribuem significativamente para a desregulação da função gênica e a instabilidade genômica observada no câncer.
4. A Dança Descontrolada: O Ciclo Celular e a Proliferação no Câncer
Para entender o crescimento descontrolado das células cancerosas, é fundamental compreender o ciclo celular, que é a sequência ordenada de eventos que leva uma célula a se dividir.
4.1. Fases e Pontos de Checagem do Ciclo Celular
O ciclo celular possui quatro fases principais:
G1 (Gap 1): Fase de crescimento celular e preparação para a síntese de DNA.
S (Síntese): Fase onde ocorre a replicação do DNA.
G2 (Gap 2): Fase de crescimento adicional e preparação para a mitose.
M (Mitose): Fase de divisão celular, que inclui a prófase, metáfase, anáfase, telófase e citocinese, resultando em duas células-filhas idênticas.
Para garantir a integridade do DNA e a replicação correta, existem "pontos de checagem" (ou de restrição/críticos) no ciclo celular. Os mais importantes estão localizados entre G1 e S (G1/S) e entre G2 e M (G2/M).
4.2. Reguladores do Ciclo Celular
A progressão através do ciclo celular é orquestrada por um complexo sistema de proteínas, sendo as mais importantes:
Ciclinas: Proteínas que têm seus níveis oscilantes ao longo do ciclo, determinando o momento apropriado para a ativação de outras enzimas.
Quinases Dependente de Ciclinas (CDKs): Enzimas que se associam às ciclinas e fosforilam proteínas-chave, permitindo a transição entre as fases do ciclo. As CDKs mais relevantes incluem CDK1, CDK2, CDK4 e CDK6.
Inibidores de Quinases Dependente de Ciclinas (CKIs): Proteínas que atuam como "freios" adicionais, regulando negativamente a atividade das ciclinas/CDKs. Existem duas famílias principais de CKIs: a família p21 (p21, p27, p57) e a família p16 (p16, p15, p18, p19).
4.3. Desregulação no Câncer
No câncer, ocorrem defeitos nos pontos de controle e nas proteínas reguladoras do ciclo celular, levando a uma proliferação desregulada. A maioria dos tumores humanos apresenta defeitos no controle da transição G1 para S, com alterações nas CDKs (CDK2, 4 e 6) em mais de 80-90% dos casos.
Papel do p53 e Rb na Desregulação:
Quando há dano ao DNA, o gene p53 é ativado, aumentando a transcrição de CKIs como a proteína p21. A p21 se liga às CDKs, impedindo a formação do complexo ciclina-CDK e, consequentemente, a fosforilação do Rb. Isso leva à parada do ciclo celular ou à apoptose. No ponto de checagem G2/M, o p53 ativo sequestra a proteína cdc25c, que normalmente desfosforila o complexo ciclina B-CDK1 (Fator Promotor de Mitose - FPM), impedindo a progressão para a fase M.
Se o p53 está disfuncional (mutado), o ciclo celular prossegue mesmo com erros no DNA, permitindo que células anormais se proliferem e se tornem cancerosas. O gene p53 é o mais frequentemente mutado na maioria dos cânceres humanos.
A proteína Rb atua na transição G1 para S. Quando não fosforilada, ela reprime os fatores de transcrição E2F, que são necessários para a replicação do DNA. A fosforilação do Rb pelos complexos ciclina D-CDK4/6 o inativa, liberando E2F e permitindo que a célula avance para a fase S. No câncer, mutações em Rb ou sua inativação levam à perda desse controle, resultando em proliferação desregulada.
Essas alterações permitem que as células tumorais ignorem os sinais de parada de crescimento e continuem a se dividir indefinidamente, uma das marcas mais distintivas do câncer.
5. Imortalidade Celular: O Segredo da Longevidade Tumoral – Telômeros e Telomerase
Um dos atributos mais marcantes das células tumorais é sua imortalidade celular. Diferente das células normais que possuem um "limite de vida" e número de divisões, as células cancerosas conseguem replicar-se de maneira descontrolada e ininterrupta. Esse fenômeno está intrinsecamente ligado a estruturas chamadas telômeros e à enzima telomerase.
5.1. Telômeros: Os Capacetes Protetores dos Cromossomos
Os telômeros são regiões não codificantes do genoma, localizadas nas extremidades dos cromossomos de eucariotos. Eles são compostos por sequências repetitivas de DNA (5’TTAGGG3’ em humanos) e proteínas, que formam um complexo multiproteico chamado shelterin. O papel crucial dos telômeros é manter a integridade do DNA, prevenindo sua degradação, recombinação e fusão entre cromossomos, além de serem fundamentais para a completa replicação do DNA durante a divisão celular.
5.2. O Limite de Hayflick e a Senescência Celular
Em células somáticas normais, a cada divisão celular, as extremidades teloméricas sofrem um encurtamento gradual. Isso ocorre porque a DNA-Polimerase, enzima responsável pela replicação do DNA, não consegue replicar completamente a extremidade 3' da fita descontínua do DNA. Esse encurtamento progressivo dos telômeros eventualmente atinge um tamanho mínimo crítico, um limite conhecido como Limite de Hayflick. Ao atingir esse limite, as células perdem sua capacidade replicativa e entram em um processo natural de senescência celular (envelhecimento celular) ou, em alguns casos, sofrem apoptose. A senescência replicativa e a crise celular (uma fase onde telômeros muito curtos levam a instabilidade genômica e intensa morte celular) são barreiras importantes contra a imortalidade celular e a transformação maligna.
5.3. Telomerase: A Chave da Imortalidade Tumoral
A telomerase é uma enzima do tipo ribonucleoproteína (um complexo de RNA e proteínas) que tem a função de manter o comprimento dos telômeros sintetizando suas sequências repetitivas. Ela é composta por duas subunidades principais:
TERT (telomerase reverse transcriptase): A subunidade catalítica com atividade de transcriptase reversa.
TERC (telomerase RNA component): Uma sequência de RNA que serve como fita molde para a síntese do DNA telomérico. Para que a telomerase se ligue ao telômero e exerça sua atividade catalítica, ela requer a ação de componentes proteicos do complexo shelterin, que também regulam sua atividade.
A telomerase está presente nos estágios iniciais do desenvolvimento humano, mas sua atividade é reduzida ou nula no período neonatal, permanecendo ausente na maioria dos tecidos somáticos adultos. No entanto, aproximadamente 90% das linhagens de células cancerígenas reativam o gene silenciado da enzima telomerase. Essa reativação é um dos principais mecanismos utilizados por essas células para burlar o sistema natural de senescência celular e apoptose, permitindo o alongamento dos telômeros e a replicação descontrolada e ininterrupta. Ao evitar o encurtamento crítico dos telômeros, as células cancerosas superam a crise e adquirem a imortalidade celular.
Exceção: Alongamento Alternativo de Telômeros (ALT) Em um percentual menor, entre 10% a 15% das células tumorais, o alongamento dos telômeros pode ocorrer por um mecanismo independente da telomerase, chamado Alongamento Alternativo de Telômeros (ALT). Esse processo é baseado na recombinação homóloga do DNA presente nas regiões teloméricas.
5.4. Telomerase como Alvo Promissor para Terapias Anticâncer
Devido à sua elevada expressão na maioria dos tipos de câncer e sua ausência na maioria dos tecidos normais, a telomerase se tornou um alvo importante para o desenvolvimento de terapias anticancerígenas. O objetivo é induzir seletivamente a apoptose nas células tumorais, minimizando o risco de encurtamento de telômeros em células saudáveis.
Diversas estratégias terapêuticas anti-telomerase estão em desenvolvimento:
Inibidores Diretos da Enzima Telomerase: Esses inibidores visam impedir a formação do complexo ativo da telomerase ou sua ligação ao substrato telomérico.
Imetelstat (GRN160L / GRN163L): É um oligonucleotídeo modificado que se associa ao componente TERC do RNA da telomerase, interrompendo a montagem da ribonucleoproteína (TERT + TERC) e sua atividade enzimática. Estudos pré-clínicos com Imetelstat demonstraram redução na proliferação e morte de células tumorais em diversos tipos de câncer (bexiga, fígado, pulmão, mama, pâncreas e próstata). No entanto, seus efeitos terapêuticos só foram observados após o encurtamento crítico dos telômeros, o que pode levar tempo. A suspensão do tratamento pode reverter esses efeitos.
BIBR1532: Similar ao Imetelstat, também impede a montagem da telomerase ao se ligar ao domínio TERT, interrompendo a associação TERT-RNA.
Desafio: O principal desafio para a terapia direta de inibição da telomerase é o tempo de atraso necessário para observar o encurtamento crítico dos telômeros e a morte celular. Isso significa que as células tumorais podem continuar a se replicar por um período, sugerindo que a inibição direta isolada pode ser ineficaz como tratamento autônomo, e uma combinação com outras terapias (como radiação ionizante) pode ser necessária.
Terapias que Promovem Disfunções nos Telômeros (Inibição Indireta): Essas estratégias buscam dificultar o acesso da enzima ao substrato telomérico ou alterar o telômero para que ele não se associe eficientemente às proteínas protetoras do DNA, induzindo uma resposta de dano ao DNA e morte celular mais rápida.
Nucleosídeos Modificados: Um exemplo é o 6-tio-2'-desoxiguanosina (6-thio-dG). Este nucleosídeo modificado é reconhecido e incorporado aos telômeros pela telomerase, formando telômeros alterados que induzem rapidamente respostas de dano ao DNA e morte celular em oncócitos. Importante, não foram observados efeitos em células humanas normais telomerase-negativas ou em fibroblastos normais.
Estabilizadores do G-quadruplex e Inibidores de Tnakyrase: Estas estratégias tornam os telômeros inacessíveis à telomerase. Os estabilizadores impedem o desenrolamento da estrutura G-quadruplex na extremidade 3', e os inibidores de Tnakyrase inibem a dissociação da proteína TRF1 (componente do shelterin) dos telômeros.
Imunoterapia Antitelomerase: Ainda em desenvolvimento, essa abordagem visa sensibilizar o sistema imunológico contra células tumorais que expressam peptídeos antigênicos de telomerases degradadas em suas membranas celulares. Esses epítopos antigênicos podem induzir respostas de linfócitos T citotóxicos (CD4+ ou CD8+) específicas contra tumores positivos para telomerase.
Apesar dos avanços significativos, é fundamental notar que, até o momento, não existem agentes antitelomerásicos aprovados para uso clínico. No entanto, a telomerase permanece como um alvo terapêutico promissor.
6. Metástase: A Disseminação e Colonização do Câncer
A metástase é o processo pelo qual as células cancerosas se espalham do local do tumor original para outras partes do corpo. É a principal causa de morte por câncer, sendo responsável por aproximadamente 90% dos óbitos relacionados à doença.
6.1. Vias de Disseminação
As células cancerosas podem se deslocar e invadir novos locais por diversas vias:
Via Sanguínea (Hematogênica): As células se desprendem, entram em vasos sanguíneos e são transportadas pela corrente sanguínea para órgãos distantes.
Via Linfática: As células invadem vasos linfáticos, são transportadas pela linfa e podem se alojar em linfonodos regionais ou se espalhar ainda mais.
Cavidades do Corpo: As células podem se desprender e se deslocar dentro de cavidades corporais, como o peritônio (na cavidade abdominal) ou a pleura (na cavidade torácica), formando implantes secundários.
Outras Vias (Raras): Em casos raros, metástases foram observadas após transplante de tecidos ou por transferência materno-fetal.
6.2. A Cascata Metastática: Um Processo Multifatorial
O processo de metástase não é aleatório, mas sim uma "cascata metastática" complexa e multifatorial, envolvendo duas fases principais: a translocação e a colonização.
Fase 1: Translocação das Células Metastáticas Este estágio envolve o desprendimento das células do tumor primário e sua chegada a um tecido distante.
Desprendimento e Invasão Local: As células tumorais adquirem a capacidade de migrar e invadir tecidos. Elas precisam se descolar de sua colônia original, perdendo sua adesão (que era essencial para a sobrevivência no tumor primário), e se mover através da matriz extracelular do tecido circundante. Estruturas citoplasmáticas chamadas invadopodias auxiliam essa mobilidade, expressando receptores de adesão e proteases que degradam a matriz extracelular, permitindo a tração e locomoção da célula. A atividade de proteínas como RhoC e RhoA está correlacionada com o aumento da invasão e mobilidade.
Transição Epitelial-Mesenquimal (EMT): Um mecanismo crucial que permite às células epiteliais (que formam a maioria dos tumores) adquirir características de células mesenquimais, tornando-as mais móveis e invasivas. Essa transição envolve o rompimento de ligações celulares e a individualização das células do tumor original. A regulação da E-caderina, uma molécula de adesão típica de células epiteliais, é central nesse processo; a inativação do gene da E-caderina em cânceres está associada a grandes propriedades invasivas. Um fato importante é que a EMT é um processo reversível; as células mesenquimais podem, através da transição mesenquimal-epitelial, retornar ao estado epitelial.
Intravasamento e Circulação: Após invadir o tecido adjacente, as células penetram em vasos sanguíneos ou linfáticos. Na corrente sanguínea, a maioria das células metastáticas é destruída pelo sistema imunológico (por apoptose ou células citotóxicas), ou devido ao seu tamanho (maior que o diâmetro dos capilares) ou pela agregação de plaquetas.
Células Tumorais Circulantes (CTCs): São células cancerosas encontradas no sangue periférico. Sua detecção é crucial, pois a quantidade de CTCs se correlaciona diretamente com o aumento da carga metastática e a agressividade do tumor. A presença de CTCs pode auxiliar na avaliação da malignidade, predição do risco de metástase e monitoramento da resposta ao tratamento. No entanto, a identificação de CTCs pode ser desafiadora devido ao seu tamanho, à agregação de plaquetas e à perda de marcadores de superfície durante a EMT.
Fase 2: Colonização e Adaptação das Células Cancerígenas Disseminadas As poucas células que sobrevivem à circulação se estabelecem em uma nova região e iniciam a fase de colonização, onde proliferam e formam um tumor secundário macroscópico.
Hipótese "Semente e Solo": Proposta por Stephen Paget no século XIX, essa hipótese sugere que as células metastáticas (a "semente") não se dispersam aleatoriamente, mas possuem uma afinidade específica por determinados microambientes de órgãos (o "solo"). Isso explica por que diferentes tipos de câncer tendem a metastatizar para órgãos específicos. Exemplos incluem câncer de próstata para osso, e câncer de mama para pulmões, fígado e ossos.
Adaptação ao Novo Microambiente: A colonização bem-sucedida depende da interação complexa entre a célula invasora e o microambiente do novo órgão. A instabilidade genômica e os fatores epigenéticos das células tumorais disseminadas geram populações diversas que são selecionadas para se adaptarem aos diferentes microambientes a serem colonizados.
Dormência Celular: Algumas células metastáticas podem permanecer em um estado de dormência (micrometástases), quiescentes e não proliferativas, por longos períodos. Não se sabe ao certo quais mecanismos governam essa entrada ou saída da dormência, mas mudanças no microambiente, envelhecimento ou ferimentos podem induzir a disseminação a partir desse estado.
Angiogênese na Metástase: A formação de novos vasos sanguíneos (angiogênese) é crucial não apenas para o crescimento do tumor primário, mas também para a formação e desenvolvimento de metástases. A neovascularização facilita a migração das células neoplásicas para a corrente sanguínea, e a capacidade dessas células de liberar fatores angiogênicos (como o VEGF) contribui para a degradação da membrana basal endotelial, favorecendo a invasão.
6.3. O Microambiente Tumoral: Um Cocarcinógeno Essencial
O microambiente no qual o tumor está inserido, tanto o primário quanto o secundário (metástase), desempenha um papel fundamental na promoção e manutenção do câncer. Ele é composto por diferentes tipos de células normais (células endoteliais, fibroblastos, células imunes como macrófagos e linfócitos, entre outras) e componentes da matriz extracelular. As interações complexas entre as células tumorais e esses elementos do microambiente influenciam a taxa de proliferação, a duração dos estágios da carcinogênese e até mesmo a resposta ao tratamento.
7. Desafios e Perspectivas Terapêuticas: O Futuro do Combate ao Câncer
A compreensão aprofundada dos mecanismos moleculares do câncer tem revolucionado as estratégias diagnósticas e terapêuticas. No entanto, a complexidade da doença, especialmente a heterogeneidade tumoral e a resistência a tratamentos, continua sendo um grande desafio.
7.1. Terapias Atuais e Inovadoras
Tradicionalmente, o câncer é tratado com uma combinação de cirurgia, quimioterapia e radioterapia.
Cirurgia: Principal método para remoção de tumores sólidos isolados e importante para diagnóstico.
Radioterapia: Utiliza radiação ionizante para danificar o DNA das células cancerosas, levando à morte celular.
Quimioterapia: Usa drogas citotóxicas para matar células que se dividem rapidamente.
No entanto, a pesquisa avançou para terapias mais direcionadas e personalizadas, buscando atacar as especificidades das células tumorais e seus mecanismos de evasão.
Terapia Direcionada (Targeted Therapy): Foca em diferenças moleculares específicas entre células cancerosas e normais. Por exemplo, o Imatinib (STI-571) é um inibidor de tirosina-quinase que revolucionou o tratamento da leucemia mieloide crônica. Outros fármacos como o Bevacizumab (Avastin®) são anticorpos monoclonais que se ligam ao VEGF, impedindo a formação de novos vasos sanguíneos para o tumor (terapia antiangiogênica).
Imunoterapia: Estimula o sistema imunológico do paciente para combater o câncer. Tipos incluem:
Terapia Adotiva: Células do sistema imune do paciente são retiradas, cultivadas e aprimoradas in vitro para aumentar sua letalidade direcionada, e então reinseridas no paciente (ex: TCR-T, CAR-T).
Inibidores de Checkpoint Imune (ICI): Atuam sobre receptores que as células tumorais usam para "desligar" a atividade das células imunes, permitindo que o sistema imune continue a combater o tumor.
Terapia de Diferenciação: Busca estimular as células cancerosas a se diferenciarem e reverterem para a normalidade, em vez de se proliferarem. Um exemplo de sucesso é o uso de ácido retinoico trans para tratar uma forma de leucemia, fazendo com que as células leucêmicas se diferenciem em neutrófilos normais.
Terapia Gênica: Embora ainda em fase embrionária, é uma esperança para o futuro do tratamento do câncer. A ideia é corrigir defeitos genéticos, reintroduzindo genes supressores tumorais perdidos, bloqueando oncogenes ativados ou restaurando a apoptose.
7.2. Desafios: Resistência e Personalização
A resistência aos medicamentos é um problema persistente. Células resistentes podem existir antes do tratamento ou se desenvolver sob a pressão seletiva dos fármacos. A heterogeneidade tumoral (genética e fenotípica) contribui para essa resistência, pois permite que subclones mais adaptados sobrevivam e se proliferem.
Apesar dos avanços, o caminho para a cura universal do câncer é improvável, dada a sua natureza como classe de doenças diversas. A tendência é para terapias cada vez mais individualizadas, baseadas no perfil molecular de cada tumor, buscando atacar mutações específicas e vulnerabilidades únicas.
8. Considerações Finais e o Futuro da Oncologia
O conhecimento sobre a biologia do câncer tem evoluído notavelmente ao longo dos anos. A compreensão dos mecanismos de reativação e recrutamento da telomerase, a identificação das marcas do câncer, e o entendimento detalhado da carcinogênese e metástase, abriram caminho para a criação de diversas ferramentas terapêuticas e diagnósticas.
Os avanços em estudos que estão em andamento, incorporando análises genômicas, proteômicas, epigenéticas, metabolômicas e do microbioma, combinadas com técnicas de bioinformática de alto rendimento, prometem uma elucidação ainda maior dos fatos e uma maior consolidação para futuras pesquisas.
O objetivo final é alcançar uma medicina de precisão, onde o tratamento seja escolhido de forma específica para o genótipo e fenótipo de cada tumor. Embora ainda haja muito a ser desvendado, os insights contínuos sobre os mecanismos do ciclo celular e da carcinogênese revelam um futuro promissor para a melhoria do prognóstico e da qualidade de vida dos pacientes oncológicos. O "fim da imortalidade celular" das células cancerosas está cada vez mais próximo, e com ele, a esperança de um convívio mais harmonioso ou até mesmo a cura definitiva para muitas formas de câncer.
Lista de Exercícios:
Questão 1: Qual é uma das características comuns das células cancerosas?
a) Capacidade de controlar seu crescimento e divisão celular
b) Invasão de tecidos adjacentes e metástase
c) Crescimento lento e formação de tumores benignos
d) Manutenção dos mecanismos de controle celular normais
Questão 2: O que caracteriza os tumores malignos?
a) Crescimento lento e não invasão de tecidos adjacentes
b) Capacidade de invadir tecidos adjacentes e se espalhar para outras partes do corpo
c) Manutenção dos mecanismos de controle celular normais
d) Formação de tumores benignos
Questão 3: O que é metástase no contexto do câncer?
a) Crescimento desordenado e invasão de tecidos
b) Processo pelo qual as células cancerosas se separam do tumor primário e se espalham pelo corpo
c) Formação de tumores benignos
d) Capacidade de controlar o crescimento e divisão celular
Gabarito:
Questão 1: b) Invasão de tecidos adjacentes e metástase
Questão 2: b) Capacidade de invadir tecidos adjacentes e se espalhar para outras partes do corpo
Questão 3: b) Processo pelo qual as células cancerosas se separam do tumor primário e se espalham pelo corpo