03/03/2024 • 23 min de leitura
Atualizado em 31/07/2025Proteínas e enzimas: Síntese, estrutura e função
Proteínas e Enzimas: Os Pilares da Vida Celular – Um Guia Completo sobre Síntese, Estrutura e Função
As proteínas e enzimas são biomoléculas essenciais que desempenham papéis cruciais em praticamente todos os processos biológicos. Elas são responsáveis por funções que vão desde o suporte estrutural e o transporte de substâncias até a catalise de reações químicas vitais para o metabolismo. Neste guia abrangente, vamos explorar a síntese proteica, a estrutura de proteínas em seus diferentes níveis, as funções das enzimas como catalisadores biológicos, os modelos de sua interação com substratos e os mecanismos sofisticados de regulação enzimática.
Parte 1: Proteínas – Os Blocos Construtores Multifuncionais
Para começar nossa jornada de forma didática, vamos entender o que são as proteínas e por que são tão importantes.
1. O Que São Proteínas?
As proteínas são as moléculas mais abundantes no corpo humano, com exceção da água. Elas são polímeros lineares complexos construídos a partir de unidades menores chamadas aminoácidos. Imagine um colar de contas onde cada conta é um aminoácido – a ordem e o tipo dessas contas determinam a identidade e a função do colar final, que é a proteína.
Pontos Chave:
Composição: As proteínas são formadas por uma sequência de até 20 L-α-aminoácidos diferentes.
Ligações Peptídicas: Os aminoácidos são unidos entre si por ligações peptídicas, formando uma cadeia polipeptídica. Cada aminoácido incorporado à cadeia é chamado de "resíduo".
Extremidades: Uma cadeia polipeptídica tem uma extremidade N-terminal (com um grupo amina livre) e uma extremidade C-terminal (com um grupo carboxílico livre).
Diferença entre Proteína, Polipeptídeo e Peptídeo (Dúvida Comum!):
Peptídeo: Geralmente refere-se a cadeias curtas de aminoácidos, frequentemente sem uma estrutura tridimensional estável.
Polipeptídeo: Pode se referir a qualquer cadeia linear de aminoácidos, independentemente do comprimento.
Proteína: Usado para designar a molécula biológica completa, que assume uma forma tridimensional estável (estrutura terciária) e é funcional.
2. Aminoácidos: A Base da Diversidade Proteica
Os aminoácidos são as unidades fundamentais das proteínas. Embora existam apenas 20 tipos "padrão" (e alguns não-naturais que podem ser introduzidos em laboratório), a combinação e a sequência desses aminoácidos conferem à proteína sua estrutura tridimensional única e, consequentemente, sua reatividade química e função biológica.
Como os Aminoácidos Variam? A diferença entre os aminoácidos reside na sua cadeia lateral, também conhecida como grupo R. As propriedades desses grupos R (tamanho, formato, reatividade, carga, capacidade de formar ligações de hidrogênio) são cruciais para o enovelamento da proteína e suas interações com o ambiente celular. Por exemplo, a prolina é uma exceção à estrutura básica comum dos aminoácidos, influenciando a conformação da cadeia.
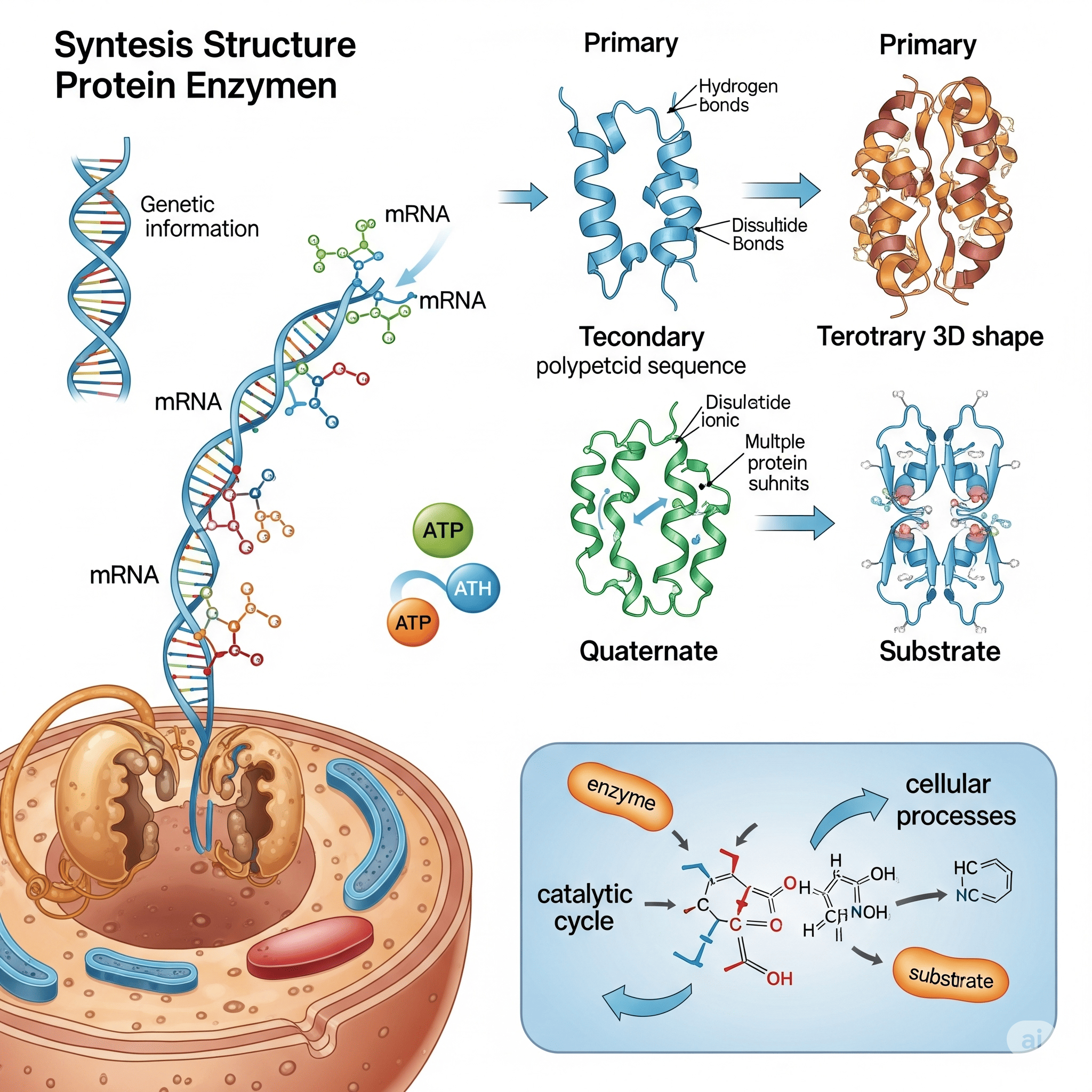
3. Síntese Proteica: Da Informação Genética à Proteína Funcional
A síntese de proteínas é um dos processos mais centrais e intrincados da biologia molecular, transformando a informação contida em nossos genes em moléculas funcionais. Este processo segue o Dogma Central da Biologia: a informação é armazenada (DNA), decodificada (RNA) e executada (Proteína).
Etapas Principais da Síntese Proteica:
Transcrição: A "cópia" da informação genética.
Onde Ocorre: No núcleo da célula (em eucariotos).
O Que Acontece: A informação de um gene no DNA é copiada para uma molécula de RNA mensageiro (mRNA). A enzima RNA polimerase é a principal responsável por essa etapa.
Passos:
Iniciação: A RNA polimerase se liga a uma região específica do gene no DNA, chamada promotor, e desenrola a dupla hélice.
Elongação: A RNA polimerase se move ao longo da fita molde do DNA, adicionando nucleotídeos de RNA complementares e sintetizando a molécula de mRNA.
Terminação: A transcrição para quando a RNA polimerase encontra uma sequência de terminação no DNA, liberando o mRNA recém-formado.
Pós-Transcrição: O mRNA recém-sintetizado passa por modificações pós-transcricionais (como splicing para remover íntrons, adição de cauda poli-A e cap na extremidade 5') para se tornar funcional e ser exportado para o citoplasma.
Tradução: A "leitura" do código para formar a proteína.
Onde Ocorre: No citoplasma, em estruturas chamadas ribossomos.
O Que Acontece: Os ribossomos leem a sequência de códons (grupos de três nucleotídeos) no mRNA, e cada códon corresponde a um aminoácido específico.
Componentes Chave:
Ribossomos: São as "fábricas" da proteína, compostos por RNA ribossômico (rRNA) e proteínas. Ponto Importante para Concursos: Ribossomos em eucariotos (80S) são maiores que em procariotos (70S), uma diferença explorada por alguns antibióticos para inibir a síntese proteica bacteriana seletivamente. O rRNA tem papel estrutural e catalítico (ajuda a formar ligações peptídicas).
RNA transportador (tRNA): Moléculas que "transportam" os aminoácidos corretos para o ribossomo, de acordo com o códon lido no mRNA.
Código Genético: O "dicionário" que traduz as sequências de nucleotídeos em aminoácidos. É composto por 64 códons, dos quais 61 codificam os 20 aminoácidos e 3 são códons de parada. Curiosidade: O código é degenerado, o que significa que um aminoácido pode ser codificado por mais de um códon.
Passos:
Iniciação: A subunidade menor do ribossomo se liga ao mRNA e procura o códon de iniciação (AUG), que sempre codifica a metionina. O tRNA com metionina se liga, e a subunidade maior do ribossomo se junta, formando o complexo de iniciação.
Elongação: O ribossomo se move ao longo do mRNA, lendo os códons. Para cada códon, o tRNA correspondente traz um aminoácido, que é adicionado à cadeia proteica em crescimento. O ribossomo possui três sítios funcionais (A, P e E) para esse processo.
Terminação: A tradução para quando o ribossomo encontra um códon de parada (UAA, UAG ou UGA). Fatores de liberação auxiliam na dissociação do complexo, liberando a proteína recém-sintetizada.
4. Estrutura das Proteínas: A Forma que Define a Função
A estrutura tridimensional de uma proteína é fundamental para sua função biológica. Uma proteína precisa se "enovelar" na sua forma correta, chamada conformação nativa, para ser ativa. Se ela perder essa forma (processo de desnaturação), sua função é comprometida.
Níveis Estruturais das Proteínas (do Mais Simples ao Mais Complexo):
Estrutura Primária:
É a sequência linear de aminoácidos unidos por ligações peptídicas.
É o nível mais simples, mas o mais importante, pois determina todos os outros níveis estruturais e, consequentemente, a função da proteína. A informação para a estrutura nativa está contida na sequência de aminoácidos.
Estrutura Secundária:
Refere-se a padrões de dobramento locais e repetitivos da cadeia polipeptídica.
Esses padrões são estabilizados principalmente por pontes de hidrogênio formadas entre os grupos amina e carboxila da cadeia principal da proteína.
Tipos Comuns (muito cobrados!):
Alfa-hélice (α-hélice): Uma estrutura cilíndrica em espiral, semelhante a uma mola, onde a cadeia polipeptídica é torcida para a direita. As cadeias laterais dos aminoácidos (grupos R) se projetam para fora da hélice.
Folha-beta (β-folha): Uma estrutura achatada e pregueada, formada por regiões adjacentes da cadeia polipeptídica que se alinham lado a lado e se conectam por pontes de hidrogênio. As cadeias laterais se projetam em ziguezague acima e abaixo da folha. Pode ser paralela ou antiparalela.
Voltas (Turns/β-turns) e Alças (Loops): Conectam os segmentos de alfa-hélices e folhas-beta, permitindo que a cadeia mude de direção. As voltas são mais curtas e estabilizadas por pontes de hidrogênio específicas. As alças são segmentos maiores e mais variáveis.
Estrutura Terciária:
É o dobramento tridimensional global de uma única cadeia polipeptídica.
É a forma compacta e funcional da proteína.
Estabilizada por diversas interações:
Interações Hidrofóbicas (Efeito Hidrofóbico): Considerado o principal motor do enovelamento. Aminoácidos com cadeias laterais apolares (hidrofóbicas) tendem a se agrupar no interior da proteína, longe do ambiente aquoso, minimizando o contato com a água. Aminoácidos polares e carregados ficam na superfície, interagindo com o solvente.
Pontes de Hidrogênio: Embora menos contribuam para a estabilidade global em solução aquosa (devido à competição com a água), são cruciais para a estrutura secundária e podem ocorrer entre grupos R.
Interações Iônicas (Pontes Salinas): Atrações eletrostáticas entre grupos carregados positivamente e negativamente nos grupos R dos aminoácidos.
Pontes Dissulfeto: Ligações covalentes fortes formadas entre dois resíduos de cisteína. São muito importantes para estabilizar a estrutura terciária, especialmente em proteínas que atuam em ambientes oxidativos, como o retículo endoplasmático rugoso (RER) ou fora da célula. Exceção/Ponto de Concurso: Não são formadas no citosol (ambiente redutor).
Estrutura Quaternária:
Refere-se à associação e organização de duas ou mais cadeias polipeptídicas (subunidades) para formar um complexo proteico funcional.
Nem todas as proteínas possuem estrutura quaternária; proteínas monoméricas consistem em apenas uma cadeia.
5. Enovelamento de Proteínas: O Desafio da Conformação
O enovelamento (folding) é o processo pelo qual uma cadeia polipeptídica recém-sintetizada adquire sua forma tridimensional ativa.
Pontos Cruciais sobre Enovelamento:
Dogma de Anfinsen: As informações necessárias para uma proteína obter sua estrutura nativa estão contidas exclusivamente na sua sequência de aminoácidos (estrutura primária). A forma nativa é a de menor energia e mais estável.
Paradoxo de Levinthal (Ponto para Reflexão!): Se o enovelamento fosse um processo aleatório de tentativa e erro, levaria um tempo astronomicamente longo para uma proteína pequena encontrar sua conformação nativa (bilhões de anos para uma proteína de 100 resíduos). No entanto, na realidade, ele ocorre em milissegundos ou segundos. Isso indica que o enovelamento não é aleatório, mas segue vias ou rotas específicas.
Processo Hierárquico: O enovelamento ocorre por uma série de ajustes conformacionais que reduzem a energia livre e a entropia. Segmentos locais de estrutura secundária se formam primeiro (milissegundos), seguidos pela estabilização da estrutura terciária (formação de glóbulos fundidos) e, finalmente, a organização sutil das interações (direcionamento de pontes de H, expulsão de água do cerne hidrofóbico).
Chaperonas: Algumas proteínas precisam da ajuda de chaperonas moleculares para se enovelarem corretamente. Elas guiam o processo, especialmente para proteínas grandes e complexas.
Desnaturação (O Inverso do Enovelamento):
É a perda da estrutura tridimensional nativa de uma proteína, o que geralmente leva à perda de sua função biológica.
Pode ser causada por calor (ex: fritar um ovo), variações extremas de pH, ou agentes químicos.
Algumas proteínas podem se renaturar (readquirir a forma nativa) se as condições forem restauradas, mas na maioria dos casos, a desnaturação é irreversível.
6. Modificações Pós-Traducionais: Expandindo a "Linguagem" Proteica
Após a síntese no ribossomo, a cadeia polipeptídica primária pode sofrer modificações químicas e estruturais adicionais, conhecidas como modificações pós-traducionais. Elas aumentam drasticamente a variabilidade funcional das proteínas, indo além dos 20 aminoácidos básicos.
Exemplos Notáveis (e de Relevância para Concursos):
Fosforilação:
O Que É: Adição reversível de um grupo fosfato (PO4) a resíduos de serina, treonina ou tirosina (em eucariotos).
Enzimas Envolvidas: Quinases adicionam fosfato, e fosfatases o removem.
Importância: É a modificação pós-traducional mais importante e bem estudada, atuando como um interruptor "liga/desliga" para muitas enzimas e receptores. É crucial para a transdução de sinal e o controle de processos celulares como o ciclo celular. A adição do fosfato, por ser fortemente negativo, pode induzir uma alteração radical na conformação da proteína, mudando suas características (ex: de apolar para polar).
Formação de Pontes Dissulfeto:
O Que É: Ligação covalente entre dois grupos sulfidril (-SH), geralmente de resíduos de cisteína.
Importância: Estabiliza a estrutura terciária da proteína.
Onde Ocorre: Em células eucarióticas, ocorrem no lúmen do retículo endoplasmático rugoso (RER), um ambiente oxidativo. No citosol, essas pontes são desfeitas.
Glicosilação:
O Que É: Adição de açúcares (sacarídeos) às cadeias proteicas.
Importância: Essencial para proteínas de membrana e secretórias, correta enovelamento, vida útil da proteína e adesão célula-célula.
Metilação:
O Que É: Adição de um grupo metil (CH3), principalmente a resíduos de arginina ou lisina.
Importância: Na regulação da expressão gênica, especialmente em histonas (proteínas que enrolam o DNA), sendo um fator epigenético.
Zimogênios (Pró-enzimas):
O Que São: Precursores inativos de proteínas (especialmente enzimas) que precisam ser clivados em um ponto específico para se tornarem funcionais.
Importância (Muito Cobrado!): É uma estratégia de segurança para a célula, evitando que proteínas perigosas (como enzimas digestivas) exerçam sua atividade no local ou momento errados. Se fossem ativas no órgão de produção, poderiam degradá-lo.
Exemplos Clássicos:
Pepinogênio (inativo) é ativado em pepsina (ativa) no pH ácido do estômago.
Tripsina e Quimotripsina: Enzimas digestivas produzidas no pâncreas na forma inativa (tripsinogênio e quimotripsinogênio, respectivamente) e ativadas no intestino delgado para evitar a autodigestão do pâncreas (problema na pancreatite).
Caspases: Enzimas envolvidas na apoptose (morte celular programada), sintetizadas como pró-caspases e ativadas apenas quando necessário.
7. Tipos de Proteínas (Classificação Geral)
As proteínas podem ser amplamente classificadas com base em sua forma e solubilidade, o que geralmente se correlaciona com sua função.
Proteínas Globulares:
Assumem uma forma aproximadamente esférica ou compacta.
Geralmente solúveis em água.
Muitas enzimas são proteínas globulares.
Exemplos: Mioglobina, Triose-fosfato isomerase.
Proteínas Fibrosas:
São filamentares, com cadeias polipeptídicas estendidas ao longo de um eixo.
Função principal: estrutural e de sustentação.
Geralmente insolúveis em água.
Exemplos: Colágeno (componente principal do tecido conjuntivo) e Queratina (proteína de cabelo, unhas, chifres, pele).
Proteínas Membranares:
Associadas a membranas biológicas.
Função: Geralmente atuam como receptores (recebendo sinais) ou canais (permitindo a passagem de moléculas) através da membrana celular.
Parte 2: Enzimas – Os Catalisadores Biológicos
Agora que compreendemos a complexidade das proteínas, vamos focar em uma de suas funções mais vitais: a catálise enzimática. As enzimas são a força motriz por trás de milhares de reações bioquímicas no corpo.
1. O Que São Enzimas?
Enzimas são biomoléculas que atuam como catalisadores biológicos. Isso significa que elas aumentam a velocidade de uma determinada reação química sem serem consumidas no processo. Elas são absolutamente fundamentais para a regulação do metabolismo.
Dúvida Comum: Toda enzima é uma proteína? (Ponto de Concurso!)
A maioria das enzimas são proteínas.
Existem exceções: Alguns ácidos ribonucleicos (RNA) também podem atuar como enzimas, e são chamados de ribozimas. Portanto, a afirmação de que "toda enzima é uma proteína" NÃO ESTÁ CORRETA.
2. Propriedades Notáveis das Enzimas (Por Que São Tão Especiais?):
As enzimas se destacam dos catalisadores químicos inorgânicos (como platina ou níquel) por suas propriedades únicas:
Alto Poder Catalítico: As enzimas podem acelerar a velocidade de reações químicas por fatores impressionantes, como 10^17 vezes. Uma reação que levaria milhões de anos sem enzima, pode ocorrer em milissegundos com ela.
Condições Celulares: Elas catalisam reações em condições fisiológicas suaves (temperatura corporal de cerca de 37°C e pH próximo ao neutro, como 7.4 no plasma sanguíneo). Catalisadores químicos, por outro lado, geralmente exigem temperaturas e pressões muito elevadas e pHs extremos, que seriam letais para as células.
Especificidade: As enzimas são altamente específicas, agindo sobre reagentes específicos, chamados substratos, e catalisando um tipo particular de reação.
Especificidade Absoluta: Uma enzima se liga apenas a um substrato específico e não a moléculas muito semelhantes, como isômeros. Um exemplo é a enzima aspartase, que catalisa a adição reversível de íon amônio ao fumarato, produzindo L-aspartato, mas não reconhece o D-aspartato ou o maleato. Esse tipo de especificidade é chamado de estereoespecificidade, permitindo às enzimas distinguir moléculas pela sua forma.
Especificidade Relativa: Algumas enzimas podem reconhecer um grupo químico comum presente em diferentes substratos. Por exemplo, a quimotripsina cliva ligações peptídicas que envolvem aminoácidos aromáticos (fenilalanina, tirosina, triptofano).
Não Formam Subprodutos: Ação catalítica das enzimas é "limpa", não leva à formação de contaminantes.
Regulação da Atividade: A atividade das enzimas pode ser finamente regulada (acelerada ou diminuída) de acordo com as necessidades metabólicas da célula.
3. Sítio Ativo e o Complexo Enzima-Substrato
Para que uma enzima atue, ela precisa se ligar ao seu substrato. Essa ligação ocorre em uma região específica da enzima, conhecida como sítio ativo.
Sítio Ativo: É uma cavidade ou fenda tridimensional na superfície da enzima. Ele é formado por um arranjo de grupos químicos das cadeias laterais de poucos aminoácidos (cerca de 2-3 que participam diretamente da ligação com o substrato, de um total de cerca de 12 que formam o sítio ativo).
Por que a Enzima é Grande? (Dúvida Comum!): Se apenas alguns aminoácidos formam o sítio ativo, por que as enzimas são moléculas grandes? A maior parte da molécula da enzima é responsável por determinar e manter a configuração tridimensional exata do sítio ativo e permitir a flexibilidade necessária para a catálise. Uma proteína grande pode se curvar, torcer e enrolar para posicionar esses grupos R de forma precisa no espaço.
Complexo Enzima-Substrato: Quando a enzima se liga ao substrato, forma-se o complexo enzima-substrato (ES). Essa ligação ocorre por interações não-covalentes.
4. Modelos de Interação Enzima-Substrato (Muito Cobrado!):
Historicamente, dois modelos principais foram propostos para explicar como enzimas e substratos interagem.
Modelo Chave-Fechadura (Lock-and-Key Model):
Proposto por Emil Fischer em 1894.
Conceito: Considera que a enzima (a fechadura) e o substrato (a chave) têm um encaixe perfeito e rígido, com uma complementaridade exata em tamanho, forma e natureza química.
Limitação (Ponto Importante!): Embora popular, hoje se sabe que este modelo não está correto. Ele falha em explicar a flexibilidade das enzimas, que não são estruturas rígidas.
Modelo do Encaixe Induzido (Induced Fit Model):
Proposto por Daniel E. Koshland em 1958.
Conceito (Mais Aceito Atualmente!): O sítio ativo da enzima não tem uma forma rígida e pré-formada. Em vez disso, à medida que o substrato entra no sítio ativo, a enzima sofre uma leve modificação ou mudança conformacional. Essa alteração na forma da enzima favorece o ajuste ideal entre o sítio ativo e o substrato, e a enzima, por sua vez, pode distorcer a estrutura do substrato para facilitar a reação.
Analogia: Pode ser pensado como um "aperto de mão" que se torna mais firme após o primeiro contato.
5. Cofatores e Coenzimas: Parceiros Catalíticos
Algumas enzimas, conhecidas como enzimas conjugadas, necessitam de moléculas adicionais não-proteicas, chamadas cofatores, para realizar sua atividade catalítica. A porção proteica da enzima conjugada, quando desprovida de seu cofator, é denominada apoproteína ou apoenzima. Quando o cofator está ligado, a enzima completa e ativa é uma holoenzima.
Cofatores Inorgânicos: Geralmente são íons metálicos, como Fe²⁺, Cu²⁺, Zn²⁺.
Cofatores Orgânicos (Coenzimas): São compostos orgânicos, frequentemente derivados de vitaminas. Elas atuam como transportadores de grupos químicos específicos ou de elétrons.
Exemplos (e Suas Vitaminas de Origem):
Tiamina pirofosfato: Derivada da Tiamina (Vitamina B1). Transfere aldeídos.
Flavina Adenina Dinucleotídeo (FAD): Derivada da Riboflavina (Vitamina B2). Transfere átomos de hidrogênio.
Nicotinamida Adenina Dinucleotídeo (NAD): Derivada da Niacina (Vitamina B3). Transfere íon hidreto (H⁻).
Coenzima A: Derivada do Pantotenato (Vitamina B5). Transfere grupos acila.
Piridoxal-fosfato: Derivada da Piridoxina (Vitamina B6). Transfere grupos amino.
5'-Desoxiadenosilcobalamina (coenzima B12): Derivada da Vitamina B12. Transfere átomos de hidrogênio e unidades de carbono.
Biocitina: Derivada da Biotina (Vitamina H). Transfere CO₂.
Tetraidrofolato: Derivado do Ácido Fólico. Transfere unidades de carbono.
Grupos Prostéticos: São cofatores que se ligam de forma firme e permanente (por ligação covalente) ao sítio ativo da enzima.
6. Classificação das Enzimas
A União Internacional de Bioquímica e Biologia Molecular (IUBMB) classificou as enzimas em seis classes principais, baseadas no tipo de reação química que elas catalisam:
Oxirredutases: Catalisam reações de óxido-redução (transferência de elétrons/prótons).
Transferases: Catalisam a transferência de um grupo químico (como fosfato, amino) de uma molécula para outra.
Hidrolases: Catalisam reações de hidrólise (quebra de ligações com a adição de água).
Liases: Catalisam a quebra de ligações (C-C, C-O, C-N) por mecanismos diferentes de hidrólise ou oxidação, muitas vezes formando novas ligações duplas.
Isomerases: Catalisam reações de isomerização, rearranjando átomos dentro de uma única molécula.
Ligases: Catalisam a formação de novas ligações químicas entre duas moléculas, geralmente acopladas à hidrólise de ATP.
7. Fatores Que Regulam a Atividade Enzimática (Muito Cobrado!):
A regulação da atividade enzimática é vital para manter o metabolismo em equilíbrio e responder às necessidades celulares em constante mudança.
a) Concentração do Substrato: A velocidade de uma reação enzimática é influenciada pela concentração do substrato.
Em baixas concentrações de substrato, a velocidade da reação é baixa.
Com o aumento da concentração do substrato, a velocidade da reação enzimática aumenta.
Saturação: Chega um ponto em que todos os sítios ativos das enzimas estão ligados aos substratos. A partir daí, aumentar a concentração do substrato não aumenta significativamente a velocidade da reação, que se aproxima de um valor máximo, a velocidade máxima (Vmax).
Cinética de Michaelis-Menten: Para a maioria das enzimas, a relação entre concentração de substrato e velocidade da reação é uma curva hiperbólica retangular.
Constante de Michaelis-Menten (KM) (Essencial para Concursos!):
É a concentração de substrato necessária para que uma enzima atinja metade de sua velocidade máxima (1/2 Vmax).
Significado: O KM é um indicador da afinidade da enzima por seu substrato.
Baixo KM: Significa alta afinidade da enzima pelo substrato. A enzima atinge 1/2 Vmax com pouco substrato.
Alto KM: Significa baixa afinidade da enzima pelo substrato. É necessário muito substrato para atingir 1/2 Vmax.
O KM também oferece um valor aproximado da concentração intracelular do substrato.
b) Temperatura:
A maioria das enzimas apresenta uma temperatura ótima na qual sua atividade catalítica é máxima.
Fora dessa faixa ótima, a atividade enzimática é reduzida.
Temperaturas elevadas (geralmente acima de 50-55°C) podem causar desnaturação da enzima, levando à perda permanente de sua estrutura tridimensional e, consequentemente, de sua função biológica.
Exceção (Curiosidade para Provas!): Enzimas de bactérias termofílicas (que vivem em ambientes extremamente quentes) podem manter a atividade em temperaturas muito mais altas (acima de 85°C), como a Taq polimerase, amplamente usada em biologia molecular.
c) pH:
Assim como a temperatura, cada enzima tem um pH ótimo no qual sua atividade catalítica é máxima.
Variações de pH para valores muito ácidos ou muito alcalinos (fora do pH ótimo) podem alterar a carga dos grupos ionizáveis dos aminoácidos no sítio ativo e na estrutura da proteína, levando à desnaturação da enzima e perda de atividade.
Exemplos de pH ótimo: Pepsina (pH 1.5 no estômago), Tripsina (pH 7.7 no intestino).
8. Mecanismos de Regulação Enzimática (Aprofundamento Essencial):
Além dos fatores ambientais, as células empregam mecanismos altamente sofisticados para regular a atividade enzimática, permitindo respostas rápidas e eficientes às mudanças metabólicas.
a) Regulação Alostérica (Muito Cobrado!):
O Que É: Um mecanismo de controle onde moléculas reguladoras, chamadas moduladores (efetores/reguladores) alostéricos, se ligam à enzima em um local diferente do sítio ativo, conhecido como sítio alostérico ou sítio regulador.
Como Funciona: A ligação do modulador alostérico induz uma mudança conformacional na enzima, que é transmitida ao sítio ativo, alterando sua afinidade pelo substrato ou sua eficiência catalítica.
Natureza da Interação: A ligação dos moduladores alostéricos é não-covalente e, portanto, transitória e reversível, o que permite uma regulação rápida e momentânea.
Tipos de Moduladores:
Ativadores Alostéricos (Efetores Positivos): Aumentam a atividade da enzima ou a velocidade da reação.
Inibidores Alostéricos (Efetores Negativos): Diminuem a atividade da enzima ou a velocidade da reação.
Tipos de Regulação Alostérica:
Homotrópica: O próprio substrato atua como modulador alostérico (geralmente positivo), facilitando a ligação de moléculas adicionais de substrato.
Heterotrópica: O modulador é uma substância diferente do substrato.
Curva de Saturação (Diferença para Michaelis-Menten!): As enzimas alostéricas geralmente exibem uma curva sigmoidal (em forma de "S") de velocidade versus concentração de substrato, ao invés da curva hiperbólica de Michaelis-Menten. Isso reflete a cooperatividade entre as subunidades da enzima.
K0,5: A concentração de substrato que corresponde à metade da Vmax para enzimas alostéricas é chamada de K0,5.
Exemplos Clássicos de Regulação Alostérica (Foco para Concursos!):
Fosfofrutoquinase-1 (PFK-1): Uma enzima chave na glicólise.
Ativadores Positivos: AMP (Adenosina Monofosfato), Frutose-2,6-bifosfato. O AMP sinaliza um baixo estado energético da célula (muito consumo de ATP), ativando a PFK-1 para acelerar a produção de ATP via glicólise.
Inibidores Negativos: ATP e Citrato. ATP sinaliza um alto estado energético da célula (plenitude energética), diminuindo a atividade da PFK-1 para poupar glicose, pois outros combustíveis podem ser usados para gerar energia.
Isocitrato Desidrogenase: Uma enzima do Ciclo de Krebs, ativada por ADP e cálcio, acelerando o ciclo para aumentar a produção de ATP.
b) Modificação Covalente Reversível (Muito Importante!):
O Que É: A atividade da enzima é alterada pela ligação ou remoção covalente e transitória de um grupo químico à sua cadeia polipeptídica ou sítio ativo.
Como Funciona: Enzimas específicas (ex: quinases para adicionar fosfato, fosfatases para remover fosfato) catalisam essas modificações. A modificação (ex: adição de fosfato) induz uma mudança conformacional na enzima, que pode ativá-la ou inibí-la.
Duração do Efeito: O efeito é mais duradouro do que na regulação alostérica, pois o grupo químico permanece ligado covalentemente até ser removido por outra enzima. É como um sistema de "liga e desliga".
Vantagem: Não é necessário degradar a enzima para diminuir sua atividade, o que economiza energia celular (produzir proteínas é "caro"). A enzima permanece intacta e pronta para ser reativada.
Exemplo Chave: A regulação do metabolismo do glicogênio no fígado por hormônios como glucagon e adrenalina.
No jejum, o glucagon (e adrenalina) leva ao aumento de AMP cíclico, que ativa a Proteína Quinase A (PKA).
A PKA fosforila a glicogênio sintase, inibindo-a (impedindo a síntese de glicogênio).
A PKA também fosforila e ativa a fosforilase quinase, que por sua vez fosforila e ativa a glicogênio fosforilase (promovendo a quebra do glicogênio).
A PKA também fosforila e inibe a piruvato quinase (uma enzima da glicólise), diminuindo o consumo de glicose pelo fígado.
Ponto Importante: A fosforilação nem sempre inibe uma enzima; pode ativá-la, dependendo da enzima e do contexto. A mudança na carga do fosfato induz uma mudança na forma que altera o acesso ao sítio ativo, ativando ou inibindo.
c) Clivagem Proteolítica (Zimogênios/Pró-enzimas):
O Que É: Conforme já vimos, enzimas inativas (zimogênios) são ativadas pela quebra irreversível de uma ligação peptídica por outra enzima ou por si mesmas (autoclivagem).
Benefício: Permite o armazenamento de enzimas potencialmente perigosas em uma forma inativa, ativando-as apenas quando necessário e no local certo.
Exemplos: Enzimas digestivas (pepsinogênio, tripsinogênio) e caspases (morte celular).
d) Interação Proteína-Proteína:
O Que É: Regulação da atividade enzimática pelo contato direto de uma enzima com outras proteínas.
Natureza da Interação: Geralmente não-covalente e momentânea, semelhante à regulação alostérica.
Exemplos: Proteínas G (associadas a receptores hormonais como os de glucagon e adrenalina) e calmodulina (que interage com cálcio e outras enzimas).
e) Indução e Repressão da Expressão Gênica:
O Que É: Regulação da quantidade de enzima produzida pela célula, que ocorre diretamente no nível do DNA (transcrição).
Como Funciona: Sinais (frequentemente hormonais) podem induzir (aumentar) ou reprimir (diminuir) a transcrição dos genes que codificam as enzimas.
Duração: É um processo mais lento (horas a dias) do que a regulação alostérica ou covalente, pois envolve síntese de mRNA e proteína.
Exemplos:
Glicocinase (Hexocinase IV do fígado): Enzima induzível pela insulina, que aumenta a produção desta enzima para acelerar a glicólise após uma refeição rica em carboidratos.
Enzimas do ciclo da ureia (aumentam para lidar com amônia excessiva em jejum prolongado ou dietas hiperproteicas).
Enzimas de biotransformação (desintoxicação de xenobióticos).
f) Degradação Proteassomal/Proteolítica:
O Que É: A destruição da própria enzima por complexos proteicos chamados proteassomos, resultando na diminuição de sua quantidade na célula.
Função: Regula a concentração de enzimas e também remove proteínas danificadas ou que não são mais necessárias.
Exemplo: A enzima HMG-CoA redutase (chave na síntese de colesterol) é degradada por proteassomos quando os níveis de colesterol na célula aumentam, diminuindo a produção de colesterol.
A Dança Complexa da Vida Molecular
As proteínas e enzimas são, sem dúvida, os trabalhadores incansáveis das nossas células, orquestrando a intrincada rede do metabolismo e garantindo que a vida funcione com precisão e eficiência. Desde a intrincada síntese proteica (transcrição e tradução) que transforma a informação genética em estrutura tridimensional, passando pelos múltiplos níveis de estrutura de proteínas (primária, secundária, terciária e quaternária) que dão forma e função, até os mecanismos dinâmicos de regulação enzimática (alostérica, covalente, zimogênios, indução/repressão e degradação), cada aspecto revela uma maravilha da biologia.
Compreender esses conceitos não apenas aprofunda seu conhecimento em bioquímica, mas também o prepara para entender a base de diversas patologias e o funcionamento de muitos medicamentos. Mantenha em mente os pontos de alta prioridade para concursos – como as exceções (ribozimas), a distinção entre os modelos de interação enzima-substrato (chave-fechadura vs. encaixe induzido), os fatores que afetam a atividade enzimática (pH, temperatura, substrato) e os mecanismos de regulação.
Lista de Exercícios:
Questão 1: Onde ocorre a transcrição durante a síntese de proteínas?
a) Citoplasma
b) Ribossomos
c) Núcleo celular
d) Complexo de Golgi
Questão 2: Qual das seguintes moléculas é responsável por transportar os aminoácidos durante o processo de tradução?
a) DNA
b) RNA mensageiro (mRNA)
c) RNA ribossômico (rRNA)
d) RNA transportador (tRNA)
Questão 3: Quais são as interações que determinam a estrutura das proteínas?
a) Ligações iônicas e ligações de hidrogênio
b) Ligação peptídica e ligações covalentes
c) Ligação glicosídica e ligação fosfodiéster
d) Ligação de éster e ligação de ponte de dissulfeto
Gabarito:
Questão 1: c) Núcleo celular
Questão 2: d) RNA transportador (tRNA)
Questão 3: a) Ligações iônicas e ligações de hidrogênio