03/03/2024 • 19 min de leitura
Atualizado em 31/07/2025Regulação da expressão gênica: operons, epigenética e mutações
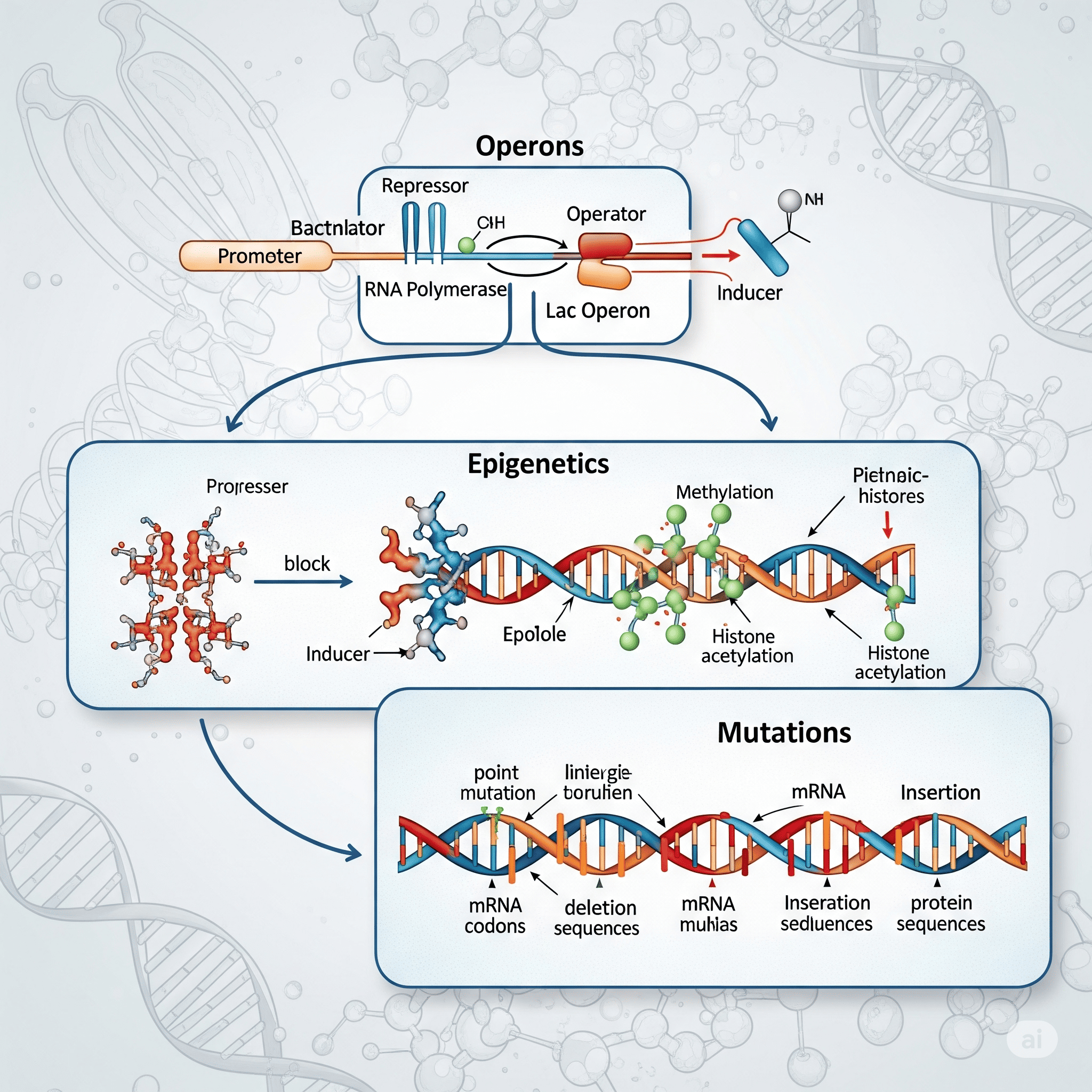
Regulação da Expressão Gênica Operons, Epigenética e Mutações
A Orquestra Molecular da Vida
Imagine uma orquestra onde cada instrumento só toca no momento certo, com a intensidade exata e apenas quando sua melodia é necessária para a harmonia geral. Assim funciona a regulação da expressão gênica em nossas células. Não é apenas sobre quais genes possuímos, mas quando, onde e em que quantidade eles são ativados para produzir suas proteínas e RNAs funcionais.
Este controle preciso é fundamental para a vida. Ele permite que uma única célula inicial (o zigoto) se diferencie em milhares de tipos celulares distintos (células da pele, neurônios, células musculares), cada uma com funções específicas, mesmo possuindo o mesmo DNA. A regulação gênica também capacita os organismos a responderem rapidamente a mudanças no ambiente, otimizando o uso de energia e recursos.
1. Desvendando o Gene: A Unidade Básica da Hereditariedade
Antes de entender a regulação, é crucial compreender a estrutura do gene. Um gene é um segmento específico de DNA que contém as instruções para produzir um transcrito de RNA e, consequentemente, uma proteína, ou para desempenhar outras funções biológicas. Todo gene, independentemente de sua origem (procarioto ou eucarioto), possui um início e um fim.
Basicamente, um gene pode ser dividido em três regiões principais:
Região Promotora: Atua como o "endereço" do gene, um sítio de ligação para a RNA polimerase, a enzima que inicia a transcrição.
Região Codificadora: Contém a informação genética que será transcrita em RNA e, na maioria dos casos, traduzida em proteína.
Sinais de Terminação da Transcrição: Indicam o fim da transcrição do gene.
2. Regulação Gênica em Procariotos: A Eficiência da Resposta Rápida
Procariotos, como as bactérias, são mestres em otimizar o uso de energia. Com cerca de 4.200 genes (no caso da E. coli), elas precisam produzir apenas cerca de 1.000 proteínas em um dado momento para evitar um custo energético desnecessário. A regulação gênica em procariotos permite que elas respondam diretamente às variações nutricionais e ambientais.
2.1. Tipos de Genes Procarióticos
Em procariotos, os genes podem ser classificados em:
Genes Constitutivos (ou de Manutenção): São expressos constantemente, pois codificam proteínas essenciais para a rotina metabólica básica da célula (ex: proteínas ribossômicas, RNAt).
Genes Induzíveis: Sua expressão é ativada apenas quando certas condições ambientais exigem, como a presença de um substrato específico.
Genes Repressíveis: Sua expressão é desativada (reprimida) quando um determinado produto metabólico está presente em excesso.
2.2. Os Mecanismos de Controle Procariótico: Repressão e Ativação
A regulação em procariotos ocorre principalmente no nível da transcrição. Isso significa que a célula decide se um gene será "ligado" (transcrito em mRNA) ou "desligado" (não transcrito). Os mecanismos básicos envolvem:
Controle Negativo: O produto de um gene regulador, chamado repressor, se liga a uma sequência de DNA específica (o operador) e impede a transcrição dos genes estruturais. Para que a transcrição ocorra, o repressor deve ser removido ou inativado.
Controle Positivo: O produto de um gene regulador, chamado ativador, é necessário para ligar a expressão de um ou mais genes estruturais, auxiliando a RNA polimerase a se ligar ao promotor.
Essas proteínas regulatórias (ativadores e repressores) são controladas por pequenas moléculas chamadas efetores alostéricos. Um efetor alostérico se liga a um sítio na proteína regulatória, alterando sua conformação e, consequentemente, sua capacidade de se ligar ao DNA.
2.3. O Modelo do Operon: Uma Unidade de Regulação Coordenada
O conceito de operon, proposto por François Jacob e Jacques Monod em 1961 (prêmio Nobel em 1965), revolucionou a compreensão da regulação gênica em procariotos. Um operon é uma unidade transcricional que agrupa genes relacionados funcionalmente e os regula de forma coordenada.
Um operon típico é composto por:
Gene Regulador (ex: lacI): Codifica a proteína repressora ou ativadora. No caso do operon lac, ele codifica o repressor Lac.
Promotor (P): Sítio de ligação para a RNA polimerase para iniciar a transcrição dos genes estruturais.
Operador (O): Sítio de ligação para a proteína regulatória (repressor ou ativador).
Genes Estruturais (ex: lacZ, lacY, lacA): Genes que codificam as proteínas cujas funções são coordenadas.
A transcrição de um operon resulta em um mRNA policistrônico (ou poligênico), um único mRNA que contém as sequências codificadoras para várias proteínas. Isso garante que todas as enzimas necessárias para uma via metabólica específica sejam produzidas em conjunto.
2.3.1. O Famoso Operon lac (Lactose): Um Exemplo Clássico
O operon lac da E. coli é o exemplo mais estudado de regulação gênica e é um tópico fundamental em concursos. Ele controla o metabolismo da lactose e é ativado quando a lactose está presente e a glicose está ausente.
Os genes estruturais do operon lac são:
lacZ: Codifica a β-galactosidase, enzima que quebra a lactose em glicose e galactose.
lacY: Codifica a β-galactosídeo permease, proteína que transporta a lactose do meio externo para dentro da bactéria.
lacA: Codifica a β-galactosídeo transacetilase, cuja função exata no metabolismo da lactose ainda é desconhecida, mas participa da acetilação de certos β-galactosídeos.
A regulação do operon lac envolve um controle duplo: negativo (pelo repressor Lac) e positivo (pelo complexo CAP-cAMP).
Cenários de Regulação do Operon lac:
Lactose Ausente, Glicose Presente (ou Ausente):
O repressor Lac (produto do gene lacI) está ativo e se liga firmemente ao operador (O).
Essa ligação bloqueia fisicamente a RNA polimerase de transcrever os genes estruturais (lacZ, lacY, lacA).
Resultado: As enzimas para metabolizar lactose não são produzidas.
Lactose Presente, Glicose Presente:
A lactose é convertida em alolactose, que atua como um indutor.
A alolactose se liga ao repressor Lac, alterando sua conformação e inativando-o. O repressor se dissocia do operador.
A RNA polimerase pode se ligar ao promotor e iniciar a transcrição.
Contudo, a presença de glicose mantém os níveis de AMP cíclico (cAMP) muito baixos, o que impede a ativação da proteína CAP (Proteína Ativadora de Catabólitos).
Sem o complexo CAP-cAMP ligado ao promotor, a ligação da RNA polimerase ao promotor é ineficiente (o promotor é "fraco").
Resultado: A transcrição do operon lac ocorre em um nível muito baixo, pois a E. coli prefere usar glicose, que é uma fonte de energia mais eficiente.
Lactose Presente, Glicose Ausente: (Cenário Ideal para Alta Expressão)
A alolactose inativa o repressor Lac, liberando o operador.
A ausência de glicose leva a altos níveis de AMP cíclico (cAMP), que se liga à proteína CAP, formando o complexo CAP-cAMP ativado.
O complexo CAP-cAMP se liga a um sítio próximo ao promotor lac e aumenta drasticamente a afinidade da RNA polimerase pelo promotor. Ele funciona como um ativador.
Resultado: A transcrição do operon lac ocorre em um nível muito alto, produzindo grande quantidade das enzimas para metabolizar lactose. Este é um exemplo de repressão catabólica, onde a presença de uma fonte de energia preferencial (glicose) reprime a transcrição de genes para outras fontes.
2.3.2. O Operon trp (Triptofano): Regulação por Repressão e Atenuação
Outro exemplo importante em procariotos é o operon trp, que controla a síntese do aminoácido triptofano. Ele é regulado por dois mecanismos:
Repressão: Quando os níveis de triptofano estão altos, o triptofano se liga à proteína repressora trpR, ativando-a para se ligar ao operador e reprimir a transcrição.
Atenuação: Este é um mecanismo mais sutil que ocorre durante a própria síntese do mRNA. Em altos níveis de triptofano, o ribossomo traduz rapidamente uma sequência "líder", causando a formação de uma estrutura de grampo no mRNA que sinaliza o fim da transcrição. Em baixos níveis de triptofano, o ribossomo "trava" na sequência líder, permitindo a formação de uma estrutura de grampo diferente que permite a continuação da transcrição.
3. Regulação Gênica em Eucariotos: A Complexidade da Multicelularidade
A regulação gênica em eucariotos é significativamente mais complexa do que em procariotos, refletindo a maior complexidade de seus genomas e a necessidade de diferenciação celular em organismos multicelulares.
Principais Diferenças para Procariotos:
Genoma Maior: Eucariotos possuem genomas muito maiores, exigindo mecanismos de "desligamento" da maioria dos genes na maior parte do tempo.
Compartimentalização: A transcrição ocorre no núcleo, e a tradução no citoplasma, permitindo etapas adicionais de controle pós-transcricional e pós-traducional.
Múltiplas RNA Polimerases: Diferentemente de procariotos com uma única RNA polimerase, eucariotos possuem três tipos: RNA Polimerase I (rRNA), RNA Polimerase II (mRNA, snRNA, miRNA) e RNA Polimerase III (tRNA, 5S rRNA, outros sRNA). A RNA Polimerase II é a principal envolvida na transcrição de genes codificadores de proteínas.
Cromatina: O DNA eucariótico é compactado em nucleossomos (DNA enrolado em proteínas histonas), formando a cromatina. A estrutura da cromatina é dinâmica e um componente essencial da regulação gênica.
Genes Interrompidos (Introns e Exons): Os genes eucarióticos são frequentemente divididos em regiões codificadoras (exons) e não codificadoras (íntrons). O RNA recém-transcrito (pré-mRNA) precisa ser processado (splicing) para remover os íntrons antes da tradução.
3.1. Remodelagem da Cromatina: Abrindo e Fechando o DNA
A cromatina pode existir em estados mais ou menos condensados:
Heterocromatina: Cromatina altamente condensada, geralmente inativa transcricionalmente.
Eucromatina: Cromatina menos condensada, mais acessível à transcrição.
A transição entre esses estados é a remodelagem da cromatina, um processo dinâmico crucial para a regulação gênica. Os nucleossomos podem ser movidos ou desmontados para expor sequências de DNA regulatórias.
Essa remodelagem é influenciada por modificações químicas nas histonas e no próprio DNA, fenômenos centrais na epigenética.
3.1.1. Modificações de Histonas
As histonas possuem "caudas" que se projetam para fora do nucleossomo e podem sofrer diversas modificações pós-traducionais. As mais relevantes para a regulação gênica incluem:
Acetilação de Histonas:
Enzimas Histona Acetiltransferases (HATs) adicionam grupos acetil aos resíduos de lisina nas caudas das histonas.
A acetilação reduz a afinidade das histonas pelo DNA, afrouxando a cromatina (tornando-a mais aberta/eucromática) e facilitando o acesso da maquinaria de transcrição.
Enzimas Histona Desacetilases (HDACs) removem os grupos acetil, promovendo a compactação da cromatina e inibindo a transcrição.
Importância para Concursos: HATs e HDACs são alvos para terapias experimentais no câncer, buscando reverter o silenciamento de genes supressores de tumor.
Metilação de Histonas:
Enzimas Histona Metiltransferases (HMTs) adicionam grupos metil a resíduos de lisina e arginina nas histonas.
Ao contrário da acetilação, a metilação pode tanto ativar quanto reprimir a transcrição, dependendo do resíduo específico metilado.
Por exemplo, a metilação da lisina 4 da histona H3 (H3K4) geralmente ativa a expressão gênica.
Já a metilação da lisina 9 (H3K9) ou 27 (H3K27) da histona H3 está associada à repressão gênica e formação de heterocromatina.
3.2. Epigenética: A Camada "Extra" de Informação
O termo epigenética significa "em adição à informação genética codificada no DNA". Refere-se a mudanças na expressão gênica que ocorrem sem alterar a sequência de nucleotídeos do DNA. Essas modificações podem ser herdadas por gerações de células (mitoticamente) ou até mesmo por gerações de organismos (transgeracionalmente), sendo um mecanismo crucial de adaptação.
Mecanismos Epigenéticos Chave:
Metilação do DNA:
É uma das modificações químicas mais comuns, envolvendo a adição de um grupo metil à posição C5 da base citosina, geralmente quando seguida por uma guanina (formando dinucleotídeos CpG).
As enzimas DNA Metiltransferases (DNMTs) são responsáveis por esse processo.
DNMT1 mantém os padrões de metilação durante a replicação do DNA.
DNMT3A e DNMT3B realizam metilações de novo (novas metilações).
Ilhas CpG: São regiões do DNA ricas em dinucleotídeos CpG, frequentemente localizadas em promotores de genes.
Normalmente, essas ilhas são não metiladas em genes ativos, permitindo a ligação de fatores de transcrição.
A hipermetilação de ilhas CpG em regiões promotoras leva ao silenciamento transcricional do gene, bloqueando o acesso de fatores de transcrição e promovendo a condensação da cromatina.
A hipometilação global do genoma também pode levar à instabilidade cromossômica e superexpressão de proto-oncogenes.
Modificações de Histonas: Já detalhadas na seção 3.1.1, essas modificações alteram a estrutura da cromatina, impactando a acessibilidade do DNA para a transcrição.
Silenciamento Mediado por RNA (RNAi):
Pequenas moléculas de RNA não codificantes (ncRNAs), como microRNAs (miRNAs) e small interfering RNAs (siRNAs), desempenham um papel crucial na regulação da expressão gênica, tanto a nível transcricional (silenciamento gênico transcricional - TGS) quanto pós-transcricional (silenciamento gênico pós-transcricional - PTGS) [36, do Silenciamento Gênico (RISC - RNA-induced Silencing Complex)**, que contém proteínas Argonauta (AGO).
O complexo RISC guiado pelo siRNA/miRNA reconhece sequências complementares em mRNAs-alvo, levando à sua degradação ou inibição da tradução. 8, 165], e tem grande potencial em biotecnologia e terapia gênica.
3.2.1. Fenômenos Epigenéticos Notáveis (Muito Cobrados em Concursos!)
Imprinting Genômico:
Em vez de expressar ambas as cópias de um gene (uma materna e uma paterna), em um pequeno grupo de genes imprinted, apenas uma cópia é expressa, dependendo se ela foi herdada da mãe ou do paiA* (e ATP10C) no cromossomo 15. Leva a comportamento de sociabilidade exacerbada e risadas frequentes.
Síndrome de Prader-Willi: Causada pela ausência da cópia paterna do cromossomo 15, resultando em superdosagem dos produtos desses genes (ou ausência da expressão paterna). Caracterizada por teimosia, fúria e propensão à psicose.
**Inativação do Cromossomo X:igenética, Saúde e Doença (Foco em Concursos de Saúde)
As alterações epigenéticas não são apenas parte do desenvolvimento normal, mas também estão diretamente relacionadas a diversas patologias.
Câncer: É o campo mais estudado da relação entre epigenética e doença.
Células cancerosas frequentemente exibem hipometilação global do genoma (levando à instabilidade cromossômica e ativação de proto-oncogenes) e hipermetilação de ilhas CpG em promotores de genes supressores de tumor.
O silenciamento de genes supressores de tumor (que normalmente controlam o ciclo celular, reparo de DNA e apoptose) permite a proliferação celular desordenada e o desenvolvimento do câncer.
Perturbações nas marcas epigenéticas das histonas também são observadas em células tumorais.
Doenças Neurológicas e do Desenvolvimento:
Estudos recentes indicam a participação da epigenética em síndromes como as já mencionadas de Angelman e Prader-Willi.
Outras desordens como a Síndrome de Rubinstein-Taybi, Síndrome de Coffin-Lowry e Síndrome de Rett estão associadas a mutações em genes que estabelecem marcações epigenéticas.
Erros de imprinting transmitidos durante a reprodução assistida podem levar a patologias neurológicas e de desenvolvimento.
Terapia Epigenética: É uma área de pesquisa promissora que busca desenvolver medicamentos capazes de reverter padrões de metilação e acetilação alterados em doenças como o câncer. Drogas que inibem as DNA metiltransferases ou as histonas deacetilases estão em fase de testes, visando reativar genes supressores de tumor silenciados.
3.3. Elementos Regulatórios e Fatores de Transcrição em Eucariotos
A transcrição em eucariotos é ativada por proteínas regulatórias chamadas fatores de transcrição (ativadores) que se ligam a sequências de DNA específicas conhecidas como elementos regulatórios de ação cis.
Promotores: Já discutidos, são os sítios próximos ao início do gene onde a RNA Polimerase II se liga. No entanto, por si só, a ligação ao promotor resulta apenas em uma transcrição basal (muito baixa).
Elementos Proximais ao Promotor (UPEs - Upstream Promoter Elements): Sequências localizadas a 100-200 pares de bases do sítio de início da transcrição (ex: Caixa CCAAT, segmentos ricos em GC). Fatores de transcrição que se ligam a essas regiões podem ativar a transcrição em todas as células.
Acentuadores (Enhancers): São elementos de sequência cis que podem atuar a uma distância considerável (milhares de pares de bases) do promotor, tanto a montante quanto a jusante. Eles funcionam como pontos de ligação para proteínas ativadoras e podem potencializar drasticamente a transcrição. A interação entre o acentuador e o promotor muitas vezes envolve o dobramento do DNA (looping), aproximando as regiões dist
3.4. Montagem Alternativa de RNA (Alternative Splicing)
Em eucariotos, após a transcrição do DNA em pré-mRNA, ocorre o processamento, que inclui a remoção dos íntrons (splicing). A montagem alternativa de RNA (alternative splicing) é um mecanismo crucial que permite que um único gene codifique múltiplas proteínas diferentes.
Como funciona:
Diferentes combinações de exons de um mesmo pré-**
Hormônios desempenham um papel vital na regulação gênica em eucariotos, atuando como sinais extracelulares que modulam a expressão de genes específicos.
Hormônios Esteroides (ex: estrogênio, progesterona):
São pequenas moléculas lipossolúveis que conseguem atravessar a membrana celular.
No citoplasma ou núcleo, eles se ligam a receptores nucleares ( Mutações e Variação Genética: Alterações na Informação Hereditária
A regulação gênica é fundamental para a função celular normal, mas o DNA não é estático. Alterações podem ocorrer, levando a mutações e variações genéticas.
4.1. O que é Mutação Genética?
Uma mutação genética é uma alteração permanente na sequência de nucleotídeos do DNA. Essas mudanças podem ocorrer em qualquer parte do genoma, desde um único nucleotídeo até grandes rearranjos cromossômcinógenos):** Compostos presentes na fumaça do cigarro, certos produtos químicos industriais, etc..
Aleatórias: Algumas mutações não têm uma causa clara e parecem ocorrer ao acaso.
Impacto das Mutações: Uma mutação pode afetar a célula de diversas maneiras:
Nenhum Efeito Perceptível (Mutações Neutras): Algumas mudanças na sequência do DNA não alteram a proteína produzida ou sua função.
Prejudiciais: Podem interromper a produção de proteínas, alterar sua função, ou levá-las a funcionar de forma inadequada, resultando em doenças (ex: mutação no gene da hemoglobina causando anemia falciforme).
Benéficas: Raramente, mutações podem conferir uma vantagem adaptativa ao organismo.
4.2. Mutações e Câncer (Tópico de Alta Relevância em Saúde)
As células se tornam cancerosas, em grande parte, devido a mutações em seus genes. Frequentemente, várias mutações são necessárias para que uma célula se transforme em uma célula cancerosa.
As mutações podem afetar diferentes tipos de genes que controlam o crescimento e a divisão celular:
Genes Supressores de Tumor: São genes que, em condições normais, freiam a divisão celular ou induzem a morte de células defeituosas (apoptose). Mutações em ambas as cópias de um gene supressor de tumor podem fazer com que ele pare de funcionar, contribuindo para o câncer.
Oncogenes: São versões mutadas de genes normais (proto-oncogenes) que, quando ativadas (por exemplo, em uma condição de "sempre ligado"), promovem o crescimento e a divisão celular descontrolados.
Tipos de Mutações Genéticas Relacionadas ao Câncer:
Mutações Herdadas (Germinativas/Hereditárias):
Estão presentes no óvulo ou espermatozoide e, portanto, em todas as células do corpo.
Podem ser transmitidas à próxima geração.
Acredita-se que causem uma pequena fração dos cânceres.
A herança de uma cópia anormal de um gene aumenta a probabilidade (e a rapidez) de que mutações adicionais ocorram, levando ao câncer mais cedo na vida.
Frequentemente apresentam penetrância incompleta, o que significa que nem todos os indivíduos com a mutação herdam a doença, pois outras mutações são necessárias para o desenvolvimento do câncer.
Mutações Adquiridas (Somáticas/Esporádicas):
Não estão presentes no zigoto, mas são "adquiridas" em algum momento da vida de um indivíduo.
Ocorrem em uma célula e são transmitidas apenas às células-filhas daquela célula original.
Não podem ser transmitidas à próxima geração.
São muito mais comuns do que as mutações herdadas e causam a maioria dos cânceres.
Podem ser provocadas por fatores ambientais (dieta, radiação, fumaça de cigarro) ou ocorrer aleatoriamente devido a erros na replicação do DNA.
4.3. Variação Genética: A Diversidade Natural
A variação genética refere-se à diversidade nas sequências de DNA entre indivíduos de uma população. É uma característica natural e essencial para a evolução e adaptação das espécies.
Diferença entre Variação Genética e Mutação: Mutações são as alterações permanentes na sequência do DNA. Algumas dessas mutações podem se tornar fontes de variação genética na população. Variações são mais comuns, enquanto mutações são raras.
Tipos de Variação: Podem ser pequenas diferenças em genes específicos (como polimorfismos de nucleotídeo único - SNPs, que são mudanças em apenas uma base) ou grandes diferenças cromossômicas.
Impacto na Saúde: Certas variações genéticas podem aumentar a suscetibilidade de um indivíduo a determinadas doenças (ex: diabetes, câncer, doenças cardiovasculares). Essas predisposições genéticas não garantem a doença, mas aumentam o risco. Algumas variantes podem afetar sutilmente a função gênica, como níveis hormonais ou metabolismo de toxinas, interagindo com fatores de risco ambientais.
5. Perguntas Frequentes (FAQs)
Para consolidar seu conhecimento e preparar-se para exames, abordatina** (nucleossomos). Transcrição no núcleo, tradução no citoplasma (processos desacoplados). Genes geralmente regulados individualmente (mRNA monocistrônico), embora existam exceções. Envolve remodelagem da cromatina, epigenética, múltiplos tipos de RNA polimerase, elementos regulatórios distantes (acentuadores), splicing alternativo e complexas redes de fatores de transcrição.
**2. O que é que alteram a acessibilidade do DNA para a transcrição.
3. O que são operons e por que são vantajosos para as bactérias?
Operon: É uma unidade funcional de DNA em procariotos que inclui um grupo de genes estruturais relacionados, um promotor e um operador, todos controlados por um gene regulador.
Vantagem: Permitem a regulação coordenada de genes envolvidos em uma mesma via metabólica. Isso é extremamente eficiente em termos energéticos, pois a bactéria só produz as enzimas necessárias quando os substratos estão disponíveis no ambiente e/ou a fonte de energia preferencial não está presente.
4. Como as mutações genéticas podem levar ao câncer?
Mutações podem afetar genes que controlam o crescimento e a divisão celular. Mutações em proto-oncogenes podem transformá-los em oncogenes (genes "aceleradores" que promovem o crescimento celular descontrolado). Mutações em genes supressores de tumor (genes "freios" que impedem o crescimento descontrolado) podem inativá-los. O acúmulo de múltiplas mutações nesses tipos de genes, tanto herdadas quanto adquiridas ao longo da vida, é o que geralmente leva ao desenvolvimento do câncer.
5. Por que a cromatina é tão importante na regulação gênica eucariótica?
A cromatina (DNA + histonas) determina a acessibilidade do DNA para a maquinaria de transcrição. Se o DNA está muito condensado (heterocromatina), os genes ficam inacessíveis e silenciados. Mecanismos de remodelagem da cromatina e modificações de histonas (como acetilação) podem abrir ou fechar regiões específicas da cromatina, permitindo ou impedindo a expressão gênica de forma precisa. Sem essa regulação da cromatina, a complexidade da diferenciação celular eucariótica seria impossível.
A Importância de Compreender a Regulação Gênica
A regulação da expressão gênica é um pilar da biologia molecular, conectando o genótipo ao fenótipo e explicando a incrível diversidade e adaptabilidade da vida. Desde as respostas rápidas das bactérias via operons até os complexos mecanismos epigenéticos e de RNAi em eucariotos, a capacidade de ligar e desligar genes de forma precisa é essencial para a sobrevivência e o desenvolvimento.
Para estudantes, dominar esses conceitos é crucial para compreender não apenas a biologia básica, mas também as bases moleculares de diversas doenças (especialmente o câncer) e o desenvolvimento de novas terapias genéticas e epigenéticas. Para concurseiros, operons, epigenética e mutações são temas recorrentes, e uma compreensão aprofundada, como a detalhada neste guia, será um diferencial em suas provas. Continue estudando e explorando este campo dinâmico da ciência!
Lista de Exercícios:
Questão 1: Qual dos seguintes não é um componente de um operon?
a) Promotor
b) Operador
c) Gene regulador
d) Gene estrutural
Questão 2: Qual dos seguintes processos de regulação da expressão gênica envolve mudanças na estrutura da cromatina?
a) Mutação
b) Epigenética
c) Transcrição
d) Tradução
Questão 3: Qual das seguintes afirmações é verdadeira sobre as mutações na regulação da expressão gênica?
a) Todas as mutações são prejudiciais.
b) As mutações sempre alteram a sequência de DNA.
c) As mutações podem afetar a expressão gênica sem alterar a sequência de DNA.
d) As mutações só ocorrem em genes estruturais.
Gabarito:
Questão 1: c) Gene regulador
Questão 2: b) Epigenética
Questão 3: c) As mutações podem afetar a expressão gênica sem alterar a sequência de DNA.