03/03/2024 • 22 min de leitura
Atualizado em 31/07/2025Sistema imunológico: Respostsa imune
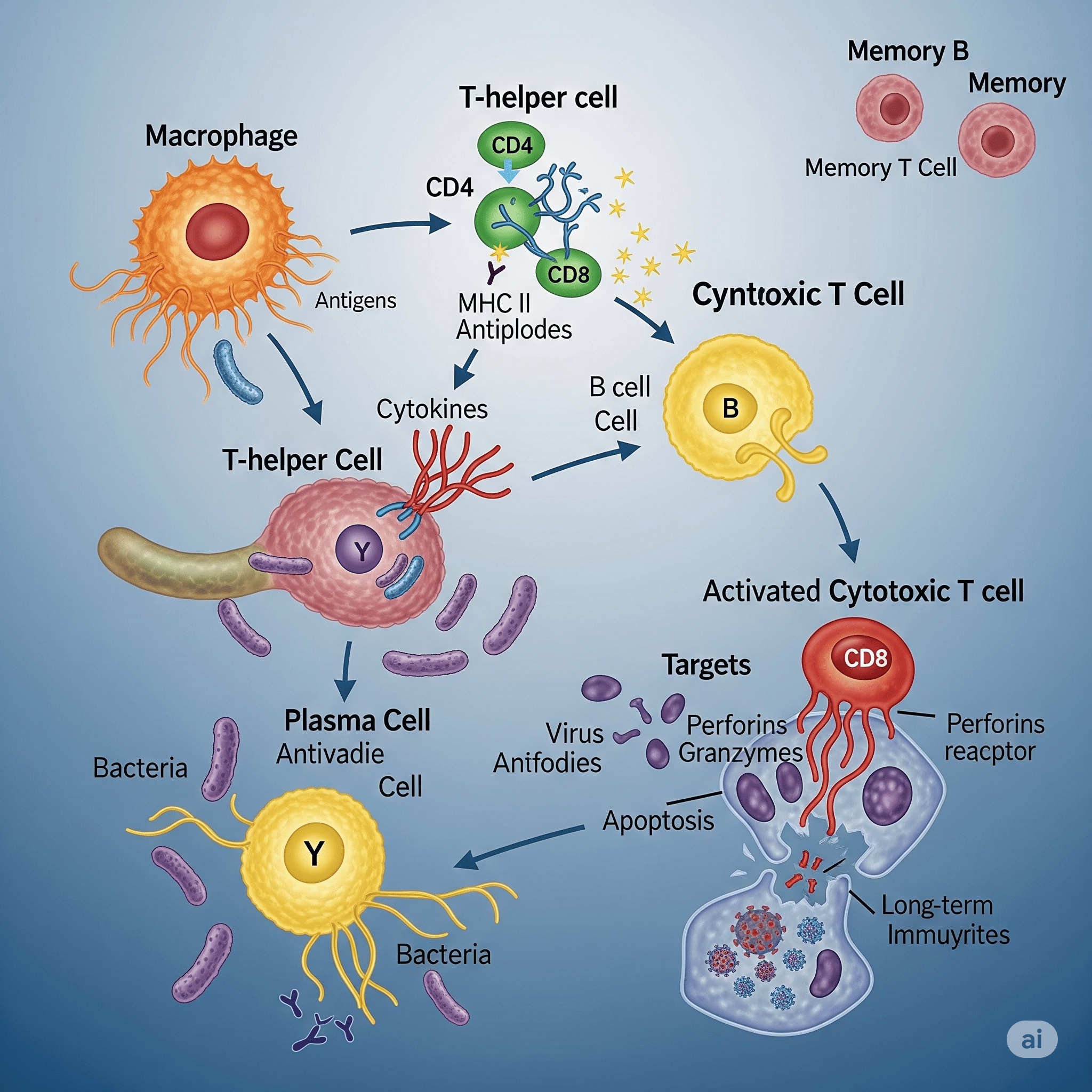
O sistema imunológico é uma maravilha da biologia humana, funcionando como o principal escudo de defesa do nosso corpo contra uma vasta gama de invasores e ameaças. Ele é uma intrincada rede de órgãos, células e moléculas que trabalham em conjunto para manter a homeostase do organismo, ou seja, o seu equilíbrio interno. Compreender seus mecanismos é fundamental, pois ele não só combate infecções, mas também desempenha um papel crucial em processos inflamatórios, doenças autoimunes e até mesmo na prevenção de certos tipos de câncer.
O Que é a Resposta Imune?
A resposta imune é a capacidade do nosso organismo de reconhecer ameaças ao seu funcionamento e os mecanismos adotados para se proteger, identificando, neutralizando os efeitos e eliminando qualquer invasor, conhecido como antígeno. Essas reações do corpo se dividem em dois tipos principais, que se complementam para garantir a máxima proteção: a imunidade inata e a imunidade adaptativa.
Imunidade Inata: A Primeira Linha de Defesa
A imunidade inata, também conhecida como natural ou não específica, é a nossa primeira linha de defesa. Ela já nasce conosco, oferecendo uma defesa imediata para frear o avanço de invasores no corpo.
Características da Imunidade Inata
Rapidez: Atua de forma muito rápida, geralmente nas primeiras 12 horas da infecção.
Não Especificidade: Reage de maneira rápida e generalizada, tentando interromper a invasão de patógenos e substâncias nocivas, independentemente de estímulo prévio.
Ausência de Memória: Não gera memória imunológica para futuras exposições ao mesmo patógeno.
Reconhecimento de Padrões: Embora não seja específica como a adaptativa, a imunidade inata reconhece padrões moleculares associados a patógenos (PAMPs) que são comuns em muitos microrganismos, mas não em células humanas. Isso torna impróprio chamá-la de "inespecífica" de forma absoluta.
Potencial de Dano Colateral: Devido à sua ação mais generalizada, os mecanismos da imunidade inata podem, por vezes, danificar tecidos saudáveis durante o ataque ao invasor.
Componentes e Mecanismos da Imunidade Inata
A imunidade inata compreende uma série de barreiras físicas, químicas e biológicas, além de componentes celulares e moléculas solúveis.
1. Barreiras Naturais
Essas barreiras atuam constantemente para bloquear a entrada microbiana:
Pele: A principal barreira física do corpo contra agentes patogênicos.
Cílios e Muco: No trato respiratório, o movimento mucociliar elimina bactérias. O muco impede a entrada de microrganismos.
Lágrima: Limpeza e lubrificação dos olhos, protegendo contra infecções.
Saliva: Possui substâncias com atividade antimicrobiana.
Suco Gástrico: Sua elevada acidez destrói bactérias que entram pelo trato digestivo superior, impedindo a proliferação de microrganismos.
Suor: Contém ácidos graxos que ajudam a pele a impedir a entrada de fungos.
Plaquetas: Atuam na coagulação do sangue, formando uma rede que impede a passagem de hemácias e retém o sangue em caso de ferimento.
2. Células Efetoras da Imunidade Inata
São células especializadas que fiscalizam e detectam microrganismos ou células danificadas, ativando as defesas:
Macrófagos: Originam-se de monócitos (células brancas circulantes) que migram do sangue para os tecidos. Atuam como sentinelas, fagocitando patógenos e detritos celulares. São importantes na defesa contra agentes intracelulares (protozoários e bactérias intracelulares). Podem permanecer nos tecidos por meses a anos. Além da fagocitose, liberam citocinas pró-inflamatórias como IL-1, IL-6, IL-12 e TNF-α, e espécies reativas de oxigênio e nitrogênio (ex: óxido nítrico - NO). Em infecções persistentes, podem formar granulomas para conter o patógeno.
Neutrófilos: São os leucócitos mais abundantes no sangue periférico e os primeiros a migrar para os locais de infecção. Sua capacidade fagocitária é essencial para combater bactérias, especialmente as extracelulares. Eles liberam grânulos contendo substâncias microbicidas (como mieloperoxidase, defensinas) e podem formar armadilhas extracelulares neutrofílicas (NETs) para conter bactérias. Neutrófilos têm vida curta, sendo eliminados por apoptose.
Células Natural Killer (NK): Um tipo de linfócito grande, fazem parte da imunidade celular mediada. Reconhecem e eliminam células infectadas por vírus e células tumorais sem necessidade de ativação prévia ou reconhecimento específico via MHC. Atuam liberando enzimas como perforinas e granzimas que induzem a morte celular por apoptose. São ativadas por IL-12 e IL-15 e produzem IFN-γ.
Células Dendríticas (DCs): Consideradas a principal ponte entre a imunidade inata e a adaptativa. São especializadas na captura e apresentação de antígenos aos linfócitos. Residem em tecidos periféricos (como as células de Langerhans na pele) e, ao encontrar um antígeno, migram para os linfonodos, onde o apresentam aos linfócitos T. Secretam citocinas e quimiocinas para recrutar outras células.
Basófilos: Contêm grânulos e liberam histamina (promovendo vasodilatação e aumento da permeabilidade vascular) e heparina (impedindo coágulos). Atuam em respostas alérgicas.
Eosinófilos: Leucócitos com grânulos importantes na defesa contra infecções parasitárias (helmintos). Podem modular reações de hipersensibilidade e destruir microrganismos liberando proteínas citotóxicas.
3. Moléculas Solúveis da Imunidade Inata
Receptores de Reconhecimento de Padrões (PRRs) e Receptores Toll-like (TLRs): Os PRRs reconhecem PAMPs (Padrões Moleculares Associados a Patógenos) e ativam a resposta imune inata. Os TLRs são um tipo de PRR com papel central na ligação a patógenos e no início da resposta inflamatória, presentes em macrófagos, neutrófilos e células dendríticas.
Sistema Complemento (SC): Uma família de mais de 20 glicoproteínas plasmáticas que, ao serem ativadas, agem em cascata para destruir microrganismos (formando o Complexo de Ataque à Membrana - MAC), otimizar a fagocitose (opsonização) e produzir mediadores que aumentam a permeabilidade vascular e atraem leucócitos. Pode ser ativado por três vias: clássica, alternativa e das lectinas ligadoras de manose.
Proteína C Reativa (PCR): Uma proteína de fase aguda produzida no fígado durante infecções bacterianas. Age como opsonina, facilita a fagocitose por neutrófilos, ativa o sistema complemento e estimula a síntese de TNF-α.
Citocinas e Quimiocinas: Moléculas de sinalização cruciais.
Citocinas pró-inflamatórias: TNF-α, IL-1, IL-6, IL-12. Produzidas nas fases iniciais da infecção, são responsáveis pela febre (que inibe a multiplicação bacteriana), aumentam a expressão de moléculas de adesão (facilitando a migração celular) e estimulam neutrófilos e macrófagos a destruir bactérias.
Quimiocinas: Grandes famílias de citocinas que direcionam a movimentação e migração de leucócitos (neutrófilos, monócitos, células T, NK, DCs) para os locais de inflamação. Exemplos incluem IL-8 e MCP-1.
Histamina: Liberada por mastócitos e basófilos, promove vasodilatação e aumenta a permeabilidade vascular.
Neuropeptídeos: Como a Substância P e o CGRP, liberados em locais de lesão, causam vasodilatação e inflamação neurogênica.
Mediadores Lipídicos: Derivados do ácido araquidônico (prostaglandinas, leucotrienos, FAP - Fator Ativador de Plaquetas) que participam de processos inflamatórios como febre, dor e vasodilatação.
O Processo Inflamatório: Uma Resposta Essencial
A inflamação é a primeira defesa do organismo a um dano tecidual, sendo um processo biológico complexo que envolve componentes vasculares, celulares e uma diversidade de substâncias solúveis. Ela se manifesta clinicamente por rubor (vermelhidão), calor, edema (inchaço), dor e prejuízo funcional.
Fases da Inflamação
Início na Microcirculação: A inflamação geralmente se inicia na microcirculação, composta por arteríolas, capilares e vênulas pós-capilares. Essa rede é vital para nutrir os tecidos com micronutrientes essenciais e limpar resíduos, além de desempenhar um papel importante na pressão sanguínea.
Fase Vascular Aguda: Após uma agressão, ocorre vasodilatação local e aumento da permeabilidade capilar, mediadas por substâncias como histamina. Isso permite a saída de eletrólitos, pequenas moléculas e, posteriormente, proteínas maiores (como albumina e fibrinogênio) do leito capilar para o espaço extravascular, formando o exsudato. Leucócitos também migram para a periferia dos vasos e aderem ao endotélio ativado.
Migração Celular (Diapedese): Leucócitos circulantes, como neutrófilos e macrófagos, são atraídos por quimiocinas (ex: IL-8) para o local da lesão. Eles realizam a diapedese, atravessando as paredes dos vasos sanguíneos para chegar ao foco da infecção e combater o agente invasor, iniciando a recuperação do tecido.
Resolução ou Cronificação:
Inflamação Aguda: Em geral, o sucesso na remoção do estímulo leva ao término rápido da resposta e ao reparo tecidual completo. É caracterizada por um aumento expressivo de leucócitos, proteínas plasmáticas e fluido derivado do sangue.
Inflamação Crônica: Se o organismo demora para eliminar o agente invasor ou o estímulo nocivo persiste, o processo inflamatório se cronifica. Nesta fase, há o recrutamento de linfócitos e monócitos, além de angiogênese (formação de novos vasos sanguíneos) e fibrose (formação excessiva de tecido conjuntivo). A inflamação crônica pode resultar em dano tecidual se for exagerada ou não modulada.
Relação com o Sistema Nervoso Central: O processo inflamatório está intrinsecamente relacionado ao sistema nervoso central. Terminações sensitivas na pele enviam sinais ao cérebro. Em locais de lesão, esses sinais podem retornar, causando uma secreção expressiva de neuropeptídeos, como a Substância P e CGRP, que provocam vasodilatação local. Fármacos como a histamina podem controlar esse efeito rebote.
Imunidade Adaptativa: A Defesa Especializada com Memória
A imunidade adaptativa, também chamada de adquirida ou específica, se desenvolve ao longo da vida mediante a exposição a patógenos ou antígenos. Ela é caracterizada pela sua resposta sob medida para cada tipo de microrganismo.
Características da Imunidade Adaptativa
Especificidade: Tem a habilidade de distinguir entre diferentes substâncias, promovendo uma resposta direcionada e eficaz para cada tipo de invasor.
Memória Imunológica: Após o primeiro contato com um patógeno, o sistema aprende a combatê-lo. Em exposições futuras ao mesmo microrganismo, a resposta é muito mais rápida e poderosa. Esta é uma diferença fundamental em relação à imunidade inata.
Lentidão Inicial: Demora mais para ser ativada, geralmente entre 1 a 7 dias após a entrada do microrganismo, pois precisa de diferenciação e expansão de linfócitos e anticorpos.
Tolerância ao Próprio Organismo: Desenvolve a capacidade de distinguir entre células próprias e não próprias, evitando danos aos tecidos saudáveis.
Tipos de Imunidade Adquirida
A imunidade adaptativa se divide em dois subtipos principais:
Imunidade Humoral:
Mediadores: É mediada por anticorpos, também conhecidos como imunoglobulinas, que são proteínas circulantes produzidas pelos linfócitos B.
Função: É o mecanismo de defesa mais importante contra microrganismos extracelulares e toxinas. Os anticorpos atuam de três maneiras principais:
Opsonização: Ligam-se ao patógeno, facilitando sua fagocitose por neutrófilos e macrófagos.
Neutralização: Impedem que microrganismos se liguem aos tecidos do hospedeiro ou neutralizam a ação de toxinas produzidas por bactérias (ex: toxinas tetânica e diftérica).
Ativação do Sistema Complemento: Ativam o sistema complemento pela via clássica, auxiliando na lise de bactérias.
Mecanismo: Linfócitos B (naives) com anticorpos de membrana específicos encontram o antígeno nos órgãos linfoides. O linfócito T auxiliar ativa o linfócito B, que então se diferencia em plasmócito, uma célula capaz de produzir e secretar grandes quantidades de anticorpos na circulação.
Imunidade Celular (Mediadas por Células - CMI):
Mediadores: É mediada principalmente por linfócitos T.
Função: Fornece defesa contra microrganismos intracelulares, como vírus, protozoários, fungos e bactérias intracelulares.
Mecanismo: Linfócitos T reconhecem os antígenos proteicos de microrganismos que as células infectadas exibem na superfície, ligados às moléculas do Complexo Maior de Histocompatibilidade (MHC).
Tipos de Linfócitos T:
Linfócitos T Auxiliares (T CD4+): Destroem células infectadas por meio da apoptose (morte programada) e coordenam a resposta imune. Têm um papel fundamental em ajudar os linfócitos B a produzir anticorpos (na imunidade humoral). Promovem respostas inflamatórias. Existem subtipos de células T CD4+:
Linfócitos Th1: Relacionados à defesa contra protozoários, bactérias intracelulares e vírus. Produzem citocinas como IFN-γ, IL-2 e TNF-α. A ativação de macrófagos por IFN-γ leva à produção de óxido nítrico (NO) e destruição bacteriana.
Linfócitos Th2: Mais eficazes contra helmintos e bactérias extracelulares. Produzem citocinas como IL-4, IL-5, IL-10 e IL-13. Estimulam a produção de IgE pelos linfócitos B e ativam eosinófilos, mastócitos e basófilos, que são componentes cruciais na defesa anti-helmíntica.
Células T Reguladoras (Tr ou Th3): Expressam moléculas CD4 e CD25 e produzem IL-10 e/ou TGF-β. São cruciais para modular a resposta imune, prevenindo ou diminuindo as consequências de reações de hipersensibilidade e doenças autoimunes, sendo indispensáveis para a homeostase do sistema imune.
Linfócitos T Citotóxicos (T CD8+): São responsáveis pela erradicação de microrganismos, normalmente vírus, que infectam e se replicam dentro de qualquer célula do corpo, incluindo as não fagocíticas. Destroem as células infectadas por meio da apoptose, liberando granzimas e perforinas.
Células Apresentadoras de Antígenos (APCs)
As APCs são essenciais para a ativação dos linfócitos T. Elas capturam, processam e apresentam os antígenos aos linfócitos. As principais APCs são:
Células Dendríticas: Como mencionado, são as mais eficientes e a principal ponte entre a imunidade inata e adaptativa. Apresentam o patógeno aos linfócitos T virgens no linfonodo, ativando-os.
Macrófagos: Fagocitam o patógeno e o apresentam aos linfócitos T auxiliares efetores, que então ativam o macrófago para digerir o antígeno.
Linfócitos B: Também atuam como APCs para iniciar a resposta adaptativa humoral, apresentando o antígeno para o linfócito T auxiliar.
Células Nucleadas Comuns do Corpo: Quando infectadas por vírus ou bactérias intracelulares, ou danificadas, podem se tornar APCs, apresentando o antígeno ao linfócito T citotóxico para que a célula inteira seja destruída, eliminando o patógeno.
Complexo Maior de Histocompatibilidade (MHC)
O MHC (conhecido como HLA em humanos) é um conjunto de genes cujas moléculas desempenham um papel central na apresentação de antígenos aos linfócitos T, estabelecendo um elo crucial entre a imunidade inata e a adaptativa.
MHC Classe I:
Localização: Presente na superfície de todas as células nucleadas do corpo.
Função: Apresenta peptídeos endógenos (originados de proteínas dentro da própria célula, como de vírus ou bactérias intracelulares) aos linfócitos T CD8+ citotóxicos. A ligação de um CD8+ a uma célula apresentando um antígeno via MHC Classe I sinaliza a destruição da célula infectada.
MHC Classe II:
Localização: Encontrado principalmente nas Células Apresentadoras de Antígenos (APCs) especializadas (macrófagos, células dendríticas e linfócitos B).
Função: Apresenta peptídeos exógenos (originados de proteínas de patógenos que foram fagocitados e processados) aos linfócitos T CD4+ auxiliares. Essa interação leva à ativação dos T CD4+ para que enviem sinais para a destruição do antígeno.
Tipos de Imunidade Adaptativa na Prática
Além da divisão humoral e celular, a imunidade adaptativa pode ser classificada quanto à sua aquisição:
Imunidade Adaptativa Ativa:
Natural: Adquirida quando o indivíduo é exposto diretamente ao antígeno através de uma doença natural (ex: pegar gripe).
Artificial: Adquirida através da vacinação, onde pequenas doses do patógeno (ou partes dele) são inoculadas para estimular a primeira resposta imune e gerar memória.
Gera Memória: Ambos os tipos geram memória imunológica, resultando em respostas mais efetivas em futuras exposições.
Imunidade Adaptativa Passiva:
Natural: Ocorre pela transferência de anticorpos diretamente para o indivíduo sem que ele precise produzi-los. Exemplos clássicos são a transferência de anticorpos da mãe para o recém-nascido através da placenta e do leite materno.
Artificial: Administração de soros contendo anticorpos (ex: soro antiofídico após picada de cobra), para fornecer proteção imediata quando não há tempo para ativar a imunidade adaptativa ativa.
Não Gera Memória: A imunidade passiva não gera memória, pois o organismo não produz os próprios anticorpos.
Órgãos do Sistema Imunológico: Onde a Defesa Acontece
O sistema imunológico é composto por um complexo sistema de órgãos, divididos em primários e secundários, onde as células de defesa são produzidas e atuam.
Órgãos Imunitários Primários
São os locais onde ocorre a produção e maturação dos linfócitos:
Medula Óssea: Tecido mole que preenche o interior dos ossos. É o local de produção de todos os elementos figurados do sangue (hemácias, leucócitos e plaquetas) e o local de maturação dos linfócitos B.
Timo: Uma glândula localizada na cavidade torácica. Sua principal função é promover o desenvolvimento e maturação dos linfócitos T.
Órgãos Imunitários Secundários
Nesses órgãos, é iniciada a resposta imune quando os linfócitos encontram os antígenos:
Linfonodos: Pequenas estruturas espalhadas pelo corpo ao longo dos vasos linfáticos. Atuam na filtragem da linfa e são locais onde os linfócitos (B e T) encontram e interagem com os antígenos apresentados pelas células dendríticas, iniciando a resposta imune específica.
Baço: Filtra o sangue, expondo-o a macrófagos e linfócitos que destroem partículas estranhas, microrganismos invasores e células sanguíneas mortas.
Tonsilas (Amígdalas): Estruturas de tecido linfoide ricas em glóbulos brancos, localizadas na garganta, que atuam como sentinelas contra patógenos inalados ou ingeridos.
Apêndice: Um pequeno órgão linfático com grande concentração de glóbulos brancos.
Placas de Peyer: Acúmulos de tecido linfoide associados ao intestino, importantes na vigilância imunológica do trato gastrointestinal.
Sistema Imunológico Baixo: Sinais de Alerta e Como Fortalecer
Quando o sistema imunológico não funciona adequadamente, sua capacidade de defesa diminui, tornando o indivíduo mais vulnerável a doenças. Isso pode se manifestar de diversas formas, desde infecções recorrentes até doenças autoimunes e neoplasias.
Sinais de Alerta de Imunodeficiência (Crucial para Concursos)
A Jeffrey Modell Foundation (JMF) listou 10 sinais de alerta que auxiliam na identificação de pacientes com suspeita de imunodeficiências primárias (IDPs). É crucial buscar avaliação imunológica se o paciente apresentar dois ou mais desses sinais:
Oito ou mais infecções de ouvido em 1 ano.
Duas ou mais infecções sinusais graves em um ano.
Dois ou mais meses com antibióticos com uma resposta pobre.
Dois ou mais episódios de pneumonia dentro de 1 ano.
Incapacidade de uma criança ganhar peso ou crescer normalmente.
Recorrentes, pele profunda ou abscessos de órgãos.
Candidíase persistente na boca ou infecção fúngica na pele.
Necessidade de antibióticos intravenosos para erradicar infecções.
Duas ou mais infecções sistêmicas (como septicemia).
A presença de história familiar de IDPs.
Importante para a Prática: Um critério adicional proposto é a "presença de manifestações autoimunes". Isso se deve ao fato de que IDPs e doenças autoimunes, inicialmente consideradas opostas, hoje são aceitas como processos interconectados, compartilhando mecanismos comuns. As doenças autoimunes manifestam-se em deficiências humorais quando o sistema imunológico produz autoanticorpos.
Avaliação da Imunidade Humoral (Muito Cobrado em Concursos)
As deficiências predominantemente de anticorpos (imunodeficiências humorais) são as mais frequentes entre as IDPs. A avaliação da imunidade humoral é geralmente o primeiro passo na investigação de uma IDP quando o setor comprometido não é óbvio, progredindo de exames mais simples para os mais complexos:
Dosagens Séricas das Classes de Anticorpos (IgM, IgG, IgA, IgE): São de grande valor para confirmar o diagnóstico das IDPs mais comuns, como a deficiência de IgA (valores séricos abaixo de 7 mg/dL em crianças acima de 4 anos). É crucial utilizar curvas-padrão para a faixa etária analisada para evitar diagnósticos errôneos, pois em crianças menores de 2 anos a produção de imunoglobulina G é gradual, e os bebês podem apresentar uma deficiência transitória.
Dosagens Séricas das Subclasses de IgG (IgG1, IgG2, IgG3, IgG4): Uma deficiência na subclasse IgG1 geralmente está associada a baixos valores de IgG total. No entanto, reduções nas subclasses IgG2, IgG3 e IgG4 podem ocorrer mesmo com valores normais de IgG total, portanto, a normalidade do IgG total não exclui deficiências de subclasses de IgG.
Titulações de Anticorpos Vacinais Antipolissacarídeos: São muito utilizadas para diagnosticar deficiências de anticorpos em casos de pneumonias de repetição, refletindo com maior precisão a deficiência de IgG2. Exemplos incluem vacinas contra pneumococos, Haemophilus influenzae tipo b, hepatite, difteria, tétano, sarampo, rubéola e vírus da poliomielite. Este exame é mais oneroso e exige titulações antes e depois da imunização. Se as dosagens de subclasses de IgG não indicarem diminuição, as titulações de anticorpos antipolissacarídeos devem ser realizadas.
Contagem de Populações de Linfócitos B (por anticorpos monoclonais anti-CD19, anti-CD20 ou anti-CD21): Relevante no diagnóstico de agamaglobulinemia congênita ligada ao X (doença de Bruton), onde há deficiência de todas as classes de imunoglobulinas devido à ausência de linfócitos B e ausência de crescimento de órgãos linfoides secundários.
Resposta Blástica a Antígenos e Mitógenos: Avalia a função dos linfócitos B frente a estímulos como o mitógeno pokeweed (para linfócitos B dependentes de T) e o antígeno proteico A do Staphylococcus aureus.
Como Fortalecer a Imunidade?
Para fortalecer o sistema imunológico e prevenir problemas de baixa imunidade, é fundamental adotar hábitos saudáveis:
Hidratação: Beber ao menos dois litros de água por dia.
Alimentação Saudável: Manter uma dieta rica em nutrientes essenciais (vitaminas e minerais) para a manutenção do organismo. Frutas cítricas como maçã, laranja e kiwi, e ômega 3, são exemplos de aliados.
Atividade Física: Praticar exercícios regularmente para estimular o bem-estar e fortalecer a imunidade.
Vacinação Completa: Ter a carteira de vacinação atualizada é crucial para desenvolver imunidade adaptativa ativa e memória contra diversas doenças.
Higiene Pessoal: Desenvolver bons hábitos de higiene para evitar contaminações.
Exposição Solar Moderada: Tomar sol com moderação para a produção de vitamina D, que também é importante para a imunidade.
Suplementação (se necessário): Verificar a possibilidade de complementar a dieta com suplementos alimentares, sob orientação médica, para garantir a ingestão de vitaminas e minerais importantes.
Exceções e Detalhes Importantes para Concursos
Algumas doenças infecciosas destacam a complexidade do sistema imune, mostrando como uma resposta desequilibrada pode levar a danos teciduais, mesmo que o sistema esteja tentando combater o agente:
Hanseníase: O espectro clínico da hanseníase está intimamente ligado ao tipo de resposta imune.
Forma Tuberculóide: Forte resposta Th1, levando à destruição de fibras nervosas e lesões localizadas. Embora o bacilo seja contido, a resposta imune é tão intensa que causa o dano.
Hanseníase Virchowiana: Ausência de uma resposta Th1 eficaz, resultando em disseminação do bacilo e macrófagos repletos de parasitas.
Reações Hansênicas (ENH e RR): Manifestações agudas que ocorrem durante ou após o tratamento, secundárias à liberação de antígenos e reações de hipersensibilidade. O Eritema Nodoso Hansênico (ENH) é uma resposta inflamatória sistêmica associada a altas concentrações de TNF-α, deposição de imunocomplexos e infiltração de neutrófilos. A Reação Reversa (RR) é uma hipersensibilidade tardia mediada por linfócitos T com produção tecidual de citocinas Th1 (IL-2, IFN-γ) e TNF-α.
Leishmaniose: A patogênese das diversas formas clínicas exemplifica a importância do equilíbrio da resposta Th1.
Em pacientes com leishmaniose cutânea e mucosa, uma forte resposta Th1 ocorre, resultando em uma inflamação muito intensa e dano aos próprios tecidos, mesmo com poucos parasitas. A produção acentuada de TNF-α e NO contribui para esse dano.
Em contraste, na leishmaniose visceral ou cutânea difusa, a deficiência de IFN-γ e alta produção de IL-10 permitem a disseminação do parasita.
Infecção pelo HIV: O Vírus da Imunodeficiência Humana (HIV) infecta predominantemente as células T CD4+, levando à sua destruição e supressão da resposta imunológica. Isso resulta em maior suscetibilidade a infecções oportunistas por agentes intracelulares (ex: M. tuberculosis, P. carinii, citomegalovírus, C. albicans). Em crianças, a alteração precoce do funcionamento dos T CD4+ também prejudica a síntese de anticorpos, tornando infecções por bactérias extracelulares comuns.
Infecção por HTLV-1: O Vírus Linfotrópico de Células T Humanas (HTLV-1) induz intensa proliferação de linfócitos T infectados, que pode levar a leucemia. A forte ativação de células Th1 na infecção por HTLV-1 pode levar a uma redução na produção de IL-4 e IL-5, diminuindo a síntese de IgE e a ativação de mastócitos/eosinófilos. Isso acarreta uma maior prevalência de esquistossomose e estrongiloidíase em pacientes infectados pelo HTLV-1, com risco de formas graves.
Infecções Virais: O controle inicial é feito por interferons tipo I (IFN-α e IFN-β), macrófagos e células NK. A imunidade adaptativa envolve a ativação de T CD8+ citotóxicos que destroem células infectadas, e T CD4+ auxiliares que colaboram com linfócitos B para produzir anticorpos. Mesmo sendo agentes intracelulares, os anticorpos são importantes na fase extracelular da replicação viral, impedindo a entrada em novas células. A patologia associada à infecção viral pode ser um efeito citopático direto do vírus, reação de hipersensibilidade ou fenômenos autoimunes.
Infecções Fúngicas: O principal mecanismo de defesa contra fungos é realizado pelos fagócitos (neutrófilos e macrófagos), que os destroem por produção de NO e outras substâncias. O IFN-γ aumenta a função dessas células, mas a atividade citotóxica das células T CD8+ não é evidenciada como central. Pacientes com neutropenia ou deficiência da imunidade celular frequentemente desenvolvem micoses recorrentes e graves.
Infecções por Helmintos: Dada a complexidade e tamanho desses parasitas, a resposta imune é múltipla. A resposta Th2 é fundamental, com a produção de IgE, ativação de eosinófilos, mastócitos e basófilos (via IL-4, IL-5, IL-13). Eosinófilos destroem esquistossômulos e Strongyloides por citotoxicidade celular dependente de anticorpos. A IL-4 e IL-13 estimulam a produção de IgE e mastócitos, aumentando a secreção de mediadores inflamatórios e muco, facilitando a expulsão dos vermes. Na esquistossomose, a fase aguda envolve TNF-α, IL-1 e IL-6 e imunocomplexos; a fase crônica envolve IL-10, IL-4, IL-5 e IL-13 na formação de granulomas e fibrose hepática.
Reações de Hipersensibilidade (Muito Cobrado em Concursos)
As reações de hipersensibilidade são respostas inflamatórias exacerbadas, mediadas pelo sistema imune, que causam dano ao próprio organismo. São classificadas em quatro tipos:
Tipo I (Imediata):
Mecanismo: Caracterizada pela presença de IgE, desencadeada por um alérgeno. A interação entre o alérgeno e a IgE pré-fixada a receptores de mastócitos e basófilos resulta na degranulação e liberação de mediadores solúveis (como histamina) e mediadores lipídicos.
Exemplos: Rinite alérgica, asma e reações anafiláticas.
Tipo II (Citotóxica ou Mediada por Anticorpos):
Mecanismo: Depende da produção de anticorpos (IgG e IgM) contra antígenos presentes na superfície das células. Causa dano por lise celular via ativação do Sistema Complemento, destruição por células NK (citotoxicidade mediada por anticorpo - ADCC) ou liberação de enzimas/citocinas por neutrófilos e macrófagos ativados.
Exemplos: Anemia hemolítica autoimune, reações transfusionais (exemplos comuns, não detalhados nos fontes fornecidas).
Tipo III (Por Imunocomplexos):
Mecanismo: Causada pela formação de imunocomplexos (ICs) antígeno-anticorpo que se depositam nos tecidos e ativam o Sistema Complemento. Envolve IgM, IgA e todas as subclasses de IgG, exceto IgG4.
Exemplos: Lúpus eritematoso sistêmico, vasculites, artrite reumatoide grave.
Tipo IV (Tardia ou Mediada por Células):
Mecanismo: Medida por linfócitos T (CD8+ causando dano direto, CD4+ secretando citocinas que ativam e recrutam células). Macrófagos são responsáveis pela magnitude da lesão tecidual e pela formação de granulomas em caso de persistência do agente infeccioso.
Exemplos: Tuberculose, hanseníase na forma tuberculóide, dermatite de contato, rejeição de transplantes (exemplos comuns, nem todos detalhados nos fontes fornecidas).
A Dança Imunológica entre Saúde e Doença
O sistema imunológico é um campo de estudo vasto e complexo, onde a interação contínua entre imunidade inata e adaptativa é a chave para a manutenção da saúde. A compreensão de seus mecanismos, desde as barreiras físicas até a intrincada rede de células e moléculas, é essencial para entender não apenas como nosso corpo combate infecções, mas também como desequilíbrios podem levar a doenças inflamatórias crônicas e autoimunes.
O processo inflamatório, apesar de vital para a defesa, deve ser finamente regulado para evitar danos colaterais. O aprofundamento na relação entre imunidade e inflamação, e na modulação dessas respostas, continua sendo uma área crucial de pesquisa, com o potencial de desenvolver novas terapias para diversas enfermidades. Para estudantes, dominar esses conceitos não é apenas uma exigência acadêmica, mas uma ferramenta poderosa para a compreensão da saúde e da doença no ser humano.
Lista de Exercícios:
Questão 1:
O que caracteriza a respostsa imune primária?
a) O sistema imunológico já tem anticorpos específicos para o antígeno.
b) É a primeira exposição do sistema imunológico a um antígeno.
c) Ocorre mais rapidamente do que a respostsa imune secundária.
d) Não envolve a ativação das células B e T.
Questão 2:
O que é memória imunológica?
a) Capacidade do sistema imunológico de não responder a substâncias próprias do corpo.
b) Capacidade do sistema imunológico de montar uma respostsa imune específica para um antígeno após a exposição inicial.
c) Capacidade do sistema imunológico de produzir mais células B e T durante uma infecção.
d) Capacidade do sistema imunológico de produzir anticorpos específicos para células cancerígenas.
Questão 3:
Qual é o objetivo principal da tolerância imunológica?
a) Evitar a respostsa imune secundária.
b) Evitar respostsas autoimunes.
c) Estimular a produção de anticorpos.
d) Ativar as células B e T.
Gabarito:
b) É a primeira exposição do sistema imunológico a um antígeno.
b) Capacidade do sistema imunológico de montar uma respostsa imune específica para um antígeno após a exposição inicial.
b) Evitar respostsas autoimunes.